实验简介
凝胶阻滞迁移率检测(electrophoresis mobility shift assay,EMSA)是一种研究转录因子与DNA结合的技术,可用于定性和定量分析。基本原理是蛋白质可以与末端标记的核酸探针结合,在非变性聚丙烯凝胶上电泳时,探针与蛋白质结合后分子量变大,比无蛋白结合的探针在凝胶中泳动的速度慢,即表现为相对滞后,同时自由探针含量也减少。EMSA可用于检测DNA结合蛋白、RNA结合蛋白, 并可通过加入特异性的抗体来检测特定的蛋白质,结合蛋白双向电泳及质谱技术进行未知蛋白的鉴定分析[1]。
EMSA的优点是简单迅速且灵敏度高;缺点是很难鉴定低亲和力的结合元件,无法鉴定蛋白复合体与DNA之间的结合,也不能反映体内蛋白与DNA的结合。
实验材料
表达载体 pET-28a (Novagen)、大肠杆菌BL21菌株。
图1 表达载体 pET-28a
(引自杨立文等,植物学报2020)
试剂
DNA探针序列
5× TBE(1L):54 g Tris、27.5 g硼酸和20 mL 0.5 M EDTA(pH8.0)。
6% TBE凝胶(25mL):2.5 mL 5× TBE、5 mL 30%丙烯酰胺(Cat No.A3291), 17.325 mL ddH2O, 150 μL 10% APS(Cat No.MKCg5404)和25 μL TEMED(Cat No.T22500)。
结合缓冲液:2 μL 10×结合缓冲液(EMSA试剂盒),1 μL 50%甘油,1 μL 100 mM MgCl2,1μL 1μg/μL–1PolydI:dC,1μL 1%NP-40。
生物素标记试剂盒(Thermo Scientific,Cat No.89818)。
EMSA试剂盒(LightShift,Cat No.20148)。
化学发光核酸检测试剂盒(Thermo Scientific,Cat No.89880)。
仪器
PCR仪,电泳仪,转膜仪,紫外切胶仪和化学发光检测仪。
实验设计要求
1. 选取转录因子可能结合的顺式作用元件以及前后各5 bp的侧翼序列,按照同一方向串联3次,组成探针。
2. 为确定转录因子与特定顺式作用元件结合的特异性,需添加竞争组作为对照实验。即利用未标记的野生型探针和未标记的突变型探针进行EMSA分析。
实验流程
实验前请详细阅读试剂盒说明书。
1. 合成DNA探针,包括野生型探针和突变型探针。
2. 标记探针。通常使用生物素标记,与32P相比不具有放射性,且便于操作。为确定转录因子与特定顺式作用元件结合的特异性,需按照以下顺序配制标记组和竞争组的反应体系。
标记组:12.5 μL超纯水,5 μL 5× TdT缓冲液,2.5 μL 1 μM未标记的Oligo,2.5 μL 5 μM Biotin-11-UTP,2.5 μL 2 U/μL DilutedTdT。
竞争组:20 μL超纯水,2.5 μL 10× 结合缓冲液(含Mg2+),2.5 μL 50 μM未标记的Oligo。
37°C避光孵育30分钟。
加入1.25 μL 0.2 M EDTA终止反应,然后加入25 μL氯仿:异戊醇(1:1),旋涡振荡混匀,16000 ×g离心1–2分钟,取上清。
随后转移至90°C孵育2分钟,缓慢降温至60°C,最后于60°C孵育30分钟。
3. 6% TBE凝胶制备及预电泳。按照配方依次加入各成分并充分混匀,注意在灌胶过程中要防止气泡的产生。待TBE凝胶完全凝固后开始预电泳,90V电泳1–2小时,电泳缓冲液为0.5× TBE缓冲液。
4. 蛋白与探针结合反应。按照以下配方配制结合反应体系。
实验组:50ng融合蛋白,0.5–2μL标记探针,6μL结合反应缓冲液,用超纯水定容至20 μL。
竞争组:50 ng融合蛋白,0.5–2 μL标记探针,过量的野生型未标记探针或突变型未标记探针,6 μL结合反应缓冲液,用超纯水定容至20 μL。
注意:通常未标记野生型或突变型探针的用量为标记探针的10倍、50倍和100倍。PolydI:dC可抑制蛋白与DNA的非特异性结合,避免形成假复合物。
5. 电泳。结合反应完毕后加入5 μL上样缓冲液,充分混匀再进行上样。电压90V,待指示剂到达胶的3/4处时即可停止电泳。
6. 转膜。将尼龙膜小心取出,放入0.5× TBE转膜缓冲液中,依次按照黑面-纤维垫-2层滤纸-胶-尼龙膜-2层滤纸-纤维垫-白面的顺序放置,注意不要有气泡产生。380 mA工作60分钟。
7. 紫外交联。取出尼龙膜用吸水纸吸干水,蛋白面朝下放入紫外交联仪中,紫外交联15分钟。
8. 封闭。将紫外交联后的尼龙膜置于干净的平皿中,加入10 mL封闭缓冲液(EMSA试剂盒),轻柔摇动15分钟。
9. 杂交。轻轻倒掉封闭缓冲液,加入8 mL结合/封闭缓冲液(EMSA试剂盒),轻柔摇动15分钟。
10. 漂洗。将尼龙膜转移至新的平皿中,加入10 mL 1× 漂洗液,轻柔漂洗5分钟,重复漂洗3次。
11. 平衡。将尼龙膜转移至新的平皿中,加入15 mL底物平衡缓冲液,轻柔摇动15分钟。取出尼龙膜,吸干多余的底物平衡缓冲液,
12. 发光检测。置于新的平皿中。加入6 mL化学发光底物至完全覆盖尼龙膜,静置孵育5分钟。最后,取出尼龙膜,从侧面吸干多余的化学发光底物,用保鲜膜包被,在化学发光成像系统(Bio-step)中曝光5分钟进行显影。
9. 数据分析。通常情况下,可以从两方面分析EMSA数据,即底部的自由探针和位于上方的迁移条带(蛋白-DNA复合物)。在加入等量标记探针的前提下,当蛋白与DNA产生互作时,底部的自由探针减少,迁移条带亮度增强。在此基础上增加未标记野生型探针会与标记探针竞争蛋白,此时自由探针条带强度基本不变,迁移条带亮度减弱;而当增加未标记的突变探针时,由于蛋白不结合该序列,突变探针不与标记探针竞争,此时自由探针减少,迁移条带亮度增强。
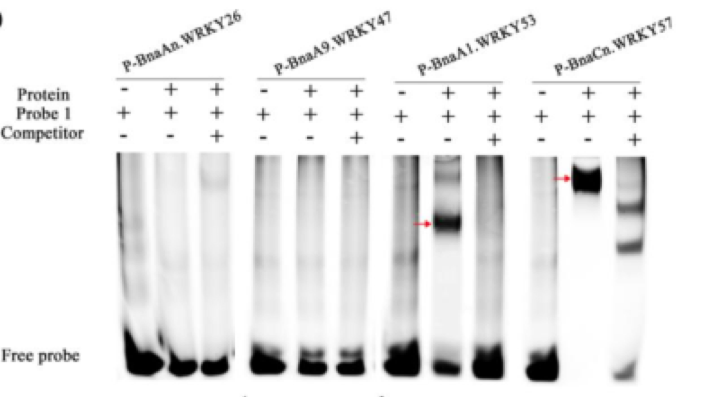
图2 EMSA结果,红色箭头表示结合条带
(引自冯英娜,华中农业大学,2020)。
注意事项
1. 合成的探针长度在40–60bp左右,有利于非结合探针和蛋白-DNA复合体的分离。
2. 标记好的探针若不立即使用,可保存于–30 °C冰箱中,再次使用时于冰上融化即可。
3. 由于不同转录因子与DNA之间结合的强度不同,在试验中要对重组蛋白用量、探针浓度以及缓冲液配方等因素进行摸索,以确定最佳实验体系。
4. 紫外交联后的尼龙膜可在室温条件下放置数天,注意在封闭之前勿再次吸湿。
5. 在操作过程中确保所用器具洁净,避免SDS或其它杂质污染。
参考文献
[1] 郑海霞,王玉国,冯智富.不同缓冲液对凝胶迁移试验的影响[J].华北农学报,2009,24(06):178-180.
[2] 杨立文, 刘双荣, 李玉红, 林荣呈 (2020). 植物转录因子与DNA互作研究技术. 植物学报 55, 468–474.
[3] 冯英娜. 转录因子WRKY47参与油菜和拟南芥响应硼胁迫的分子机制[D].华中农业大学,2020.














