中性粒细胞是循环系统中最丰富的白细胞,是肿瘤微环境的重要组成部分。中性粒细胞参与肿瘤发生发展过程中的不同阶段,包括肿瘤的发生、增殖和转移。肿瘤微环境中的中性粒细胞群体表现出异质性表型和功能多样性,在肿瘤微环境中扮演促瘤或抑瘤的双重角色。2020年7月,意大利人道大学 Alberto Mantovani教授和Andrea Ponzetta教授在nature子刊Nature Reviews cancer (IF=69.8)发表了题为“Neutrophil diversity and plasticity in tumour progression and therapy”,详尽阐述了中性粒细胞在肿瘤中的双面性及相关的治疗前景。下面将这篇综述全文翻译如下,供涉及相关研究领域的同学参考。
中性粒细胞在防御感染以及激活和调节先天性和适应性免疫方面发挥着关键作用。在癌症中,肿瘤相关中性粒细胞 (TAN)已成为肿瘤微环境的重要组成部分,发挥双重作用。TAN 可以通过驱动血管生成、细胞外基质重塑、转移和免疫抑制而成为促肿瘤炎症的一部分。相反,中性粒细胞还可以通过直接杀死肿瘤细胞和参与介导抗肿瘤抗性的细胞网络来介导抗肿瘤反应。中性粒细胞多样性和可塑性是 TAN 在肿瘤微环境中双重潜力的基础,中性粒细胞功能影响常规疗法和免疫疗法的效果。
中性粒细胞参与固有免疫和极性T辅助细胞17(TH17)细胞驱动的适应性免疫反应,从而激活下游通路,抵抗感染。中性粒细胞不仅是急性炎症的一个标志,而且它们也是协调适应性免疫反应和慢性炎症的激活、定向和调节的回路的一个重要组成部分。通过表达广泛的细胞因子、免疫抑制和刺激分子,中性粒细胞与淋巴样细胞和巨噬细胞进行复杂的双向调节作用。
肿瘤微环境(TME)是肿瘤的重要组成部分,炎症细胞和先天免疫体液成分在其中扮演关键角色,并有助于肿瘤的进展及转移。
尽管长期以来,研究者一直关注巨噬细胞在癌症相关炎症的作用,但近期一系列研究证实,中性粒细胞在癌症相关炎症中扮演重要角色。通过对中性粒细胞标记物的常规免疫组化染色进行评估发现,在不同实体瘤中,均存在不同程度的中性粒细胞浸润(例如,人类中的CD66b和小鼠中的Ly6G)。在大多数人类肿瘤中,肿瘤相关的中性粒细胞(TANs)浸润与不良预后相关。在肿瘤细胞系移植小鼠模型和癌症的基因工程小鼠模型(GEMMs)中,TANs可促进肿瘤相关炎症。然而,中性粒细胞可以直接杀死肿瘤细胞或与其他免疫细胞,抑制肿瘤的发展。因此,中性粒细胞在TME中具有致瘤和抗肿瘤的潜力。在这篇综述中,作者回顾了中性粒细胞在肿瘤进展、转移中的作用,重点描述中性粒细胞在肿瘤中的多样性及其预后、治疗意义。
中性粒细胞分别占人类和小鼠循环白细胞的50-70%和10-25%。在外周血中,中性粒细胞是短命细胞,需要依赖粒细胞集落刺激因子受体 (G-CSFR)的信号传导,从骨髓前体不断补充(方框1)。编码 G-CSFR 的集落刺激因子 3 受体 ( CSF3R )和造血细胞特异性 Lyn 底物 1 相关蛋白 X1 ( HAX1 )中的突变,与人类严重的中性粒细胞减少症有关。中性粒细胞从骨髓到外周血的运输受到严格调节,趋化因子受体 2 (CXCR2)和 CXCR4 在其中起到关键作用。骨髓基质细胞表达 CXC-趋化因子配体 12 (CXCL12),介导 CXCR4 +未成熟中性粒细胞( NI )的发育;作者使用 NI、 NM、NA和 NISG来指代未成熟中性粒细胞、成熟中性粒细胞、老化中性粒细胞和具有干扰素刺激基因特征的中性粒细胞(方框 2)。CXCR4 在骨髓内 NI 的表达降低,NM通过 CXCR2 信号激活后进入循环状态。老化的中性粒细胞上调 CXCR4 的表达,促进中性粒细胞回流到骨髓,并随后被巨噬细胞消除。造血生态位富含 CXCL12 的网状间充质干细胞 (CAR MSCs),受巨噬细胞-中性粒细胞的节律性清除调节。循环中的中性粒细胞衰老过程受到肠道微生物群的调节,并由中性粒细胞的自主转录程序进行控制。这是否适用于其他髓系细胞(如单核细胞),目前尚不清楚。在中性粒细胞中,转录因子BMAL1的表达可控制CXCL2的产生。反过来,CXCL2信号通过CXCR2诱导中性粒细胞衰老,消除凋亡的中性粒细胞并形成新的细胞,这对防止炎症和组织损伤至关重要。
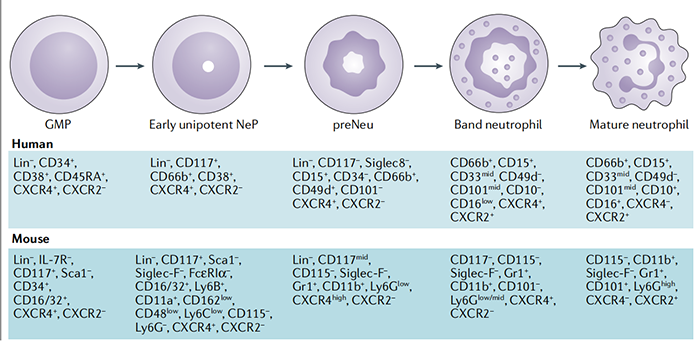
造血干细胞(HSCs)分化为髓系祖细胞(CMPs),产生粒细胞-单核细胞祖细胞(GMPs)。中性粒细胞和单核细胞的分化是由CCAAT/增强子结合蛋白-ε(C/EBPε)和生长因子独立1(GFI1)转录因子调控的,驱动中性粒细胞的产生和C/EBPα的活化。GMP向中性粒细胞的分化受到骨髓基质细胞(即粒细胞集落刺激因子(G-CSF)和粒细胞-巨噬细胞集落刺激因子(GM-CSF))的调节,并促进成髓细胞的形成。成髓细胞分化为早幼粒细胞,随后产生髓细胞、超髓细胞、带状中性粒细胞,最后是成熟的中性粒细胞。最近使用单细胞RNA测序(scRNA-seq)和飞行时间质谱流式细胞术(CyTOF)研究,进一步细化了中性粒细胞的发育过程,并确定了其分化过程中的具体步骤。上述两种技术鉴定了两个增殖中性粒细胞定向骨髓细胞亚群:早期中性粒细胞祖细胞(NePs)和中性粒细胞前粒细胞(preNeus)。NePs是neus的前体,人类NePs是单能性的,在过继转移到免疫缺陷小鼠后只产生中性粒细胞。在癌症中,由未成熟和成熟细胞组成的不同中性粒细胞亚群,可能具有免疫抑制和促肿瘤活性。图片注释:CXCR,CXC-趋化因子受体;FcεRIα、Fcε受体Iα;IL-7R,白细胞介素-7受体;Ly6,淋巴细胞抗原6。
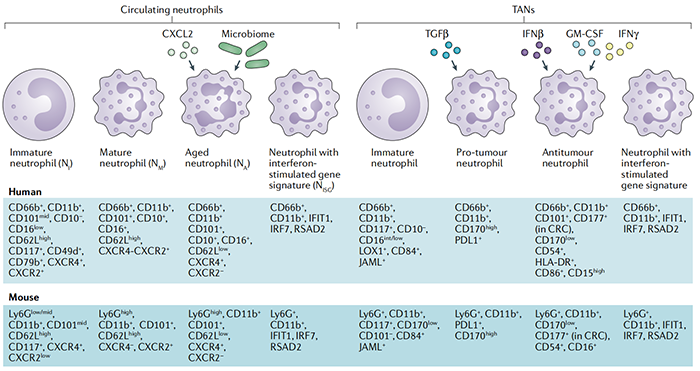
对于中性粒细胞分化和激活状态的复杂性,包括肿瘤相关的中性粒细胞(TANs)和粒细胞髓系源性抑制细胞(G-MDSCs),目前还没有共识的命名方法。根据肿瘤相关巨噬细胞(TAMs)的M1和M2分类方法,N1和N2命名法已被引入,以分别定义具有抗肿瘤和前肿瘤功能的中性粒细胞。
然而,N1和N2的定义并不平行于其他更广泛使用的1型和2型免疫反应二分法(例如T辅助1(TH1)细胞和TH2细胞;1型和2型免疫;M1和M2;组1先天淋巴细胞(ILC1)和ILC2),因为与这些细胞相比,干扰素-γ(IFNγ)、白细胞介素-12(IL-12)和IL-4不是中性粒细胞极化的关键驱动因素。
人类CD45+白细胞上CD11b和CD66b的表达,以及小鼠淋巴细胞抗原6C(Ly6C)低和Ly6g高白细胞上的CD11b的表达,可明确识别中性粒细胞。这种广泛的表型定义包括不同亚群,包括未成熟的中性粒细胞、成熟的中性粒细胞、老年中性粒细胞和表达干扰素相关基因的中性粒细胞,我们将其分别命名为NI、NM、NA和NISG。MDSCs是不成熟的髓系细胞,其免疫抑制活性与中性粒细胞(G-MDSCs)或单核细胞(单核细胞MDSCs(M-MDSCs))分化途径相关。G-MDSCs证实是具有免疫抑制活性的中性粒细胞群体。
研究者已经尝试确定中性粒细胞亚群的特异性标记物,但通过流式细胞术检测免疫抑制中性粒细胞和其他中性粒细胞亚群的明确策略仍有待开发。除了分子标记外,也可以通过密度梯度纯化来鉴定中性粒细胞。该方法发现了一个循环低密度中性粒细胞(LDN)的子集,该子集由未成熟和成熟的中性粒细胞组成。LDN在癌症中积累,具有免疫抑制能力。然而,在中性粒细胞(HDN)部分子集中也观察到免疫抑制中性粒细胞,这强调了需要一个更稳健的命名系统来定义中性粒细胞免疫抑制亚群。
最后,一系列研究发现了用于识别癌症中中性粒细胞亚群的选择分子,其中包括CD101和CD177、CD117、程序性细胞死亡1配体1(PDL1)、CD170、凝集素样氧化低密度脂蛋白受体1(LOX1)和连接粘附分子样(JAML),它们与T细胞免疫抑制和肿瘤进展相关。
图片注释:CXCL2 :CXC趋化因子配体2 ;CXCR:CXC趋化因子受体;GM-CSF:粒细胞巨噬细胞集落刺激因子HLA-DR:人白细胞抗原-DR;IFIT1:干扰素诱导蛋白四肽1;IFR7:干扰素调节因子7;RSAD2;自由基S-腺苷蛋氨酸结构域蛋白2;TGFβ:转化生长因子-β。
在小鼠和人类的肿瘤形成中,可观察到造血功能改变。生长因子(G-CSF 和 GM-CSF)和炎性细胞因子(例如,IL-6、IL-1β 和 IL-17)的产生由肿瘤细胞、肿瘤相关基质细胞和肿瘤浸润白细胞(包括T细胞、巨噬细胞和中性粒细胞)来调节。中性粒细胞增多和不成熟的骨髓细胞出现在人类和小鼠体内,这些细胞是免疫抑制的有力媒介,如下文所述(图1)。
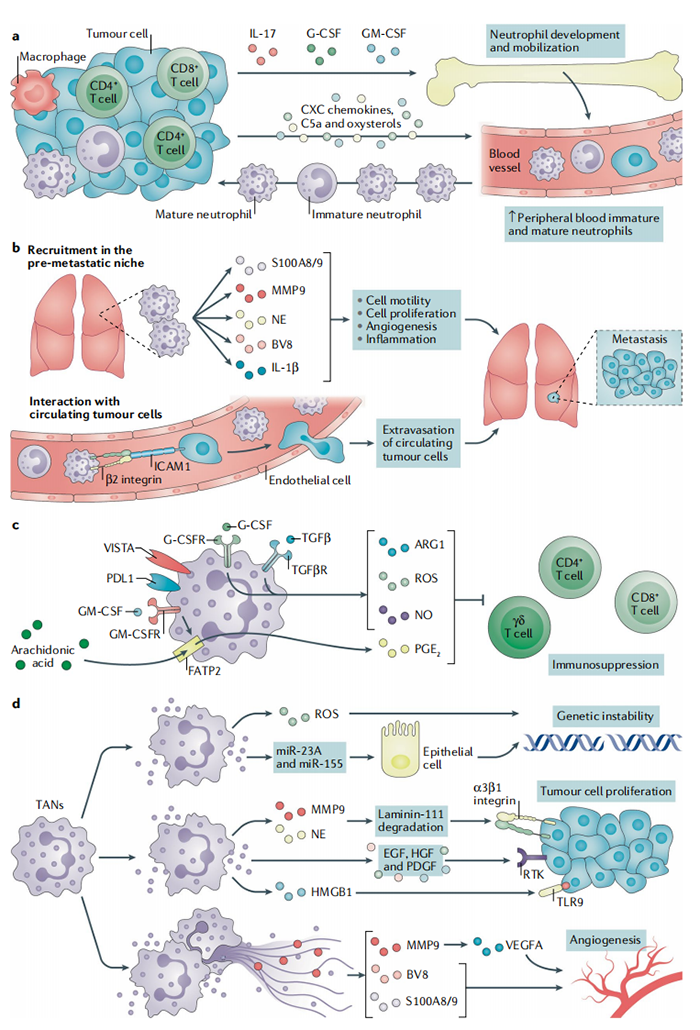
图 1:促进肿瘤的中性粒细胞。中性粒细胞可以通过不同的机制维持肿瘤的生长,包括抑制T细胞活化、促进遗传不稳定性、肿瘤细胞增殖、血管生成和转移。(a)生长因子、白细胞介素17(IL-17)、补体成分C5a、氧固醇和CXC趋化因子驱动中性粒细胞的产生、募集和存活。(b)趋化因子诱导转移前生态位中嗜中性粒细胞的动员,从而产生多种介质来维持转移细胞的活性。循环中性粒细胞保护循环肿瘤细胞,通过整合素介导,促进肿瘤细胞的存活和外渗。(c)存在于肿瘤微环境中的分子,包括粒细胞集落刺激因子(G-CSF)和转化生长因子-β(TGFβ),可诱导精氨酸酶1(ARG1)、活性氧(ROS)和一氧化氮(NO),激活中性粒细胞,抑制T细胞的活化。粒细胞-巨噬细胞集落刺激因子(GM-CSF)诱导中性粒细胞中脂肪酸转运蛋白2(FATP2)的表达,FATP2促进花生四烯酸的吸收和前列腺素E 2 (PGE 2 )的合成。中性粒细胞表达免疫检查点配体程序性细胞死亡 1 配体 1 (PDL1)、T细胞活化的 V 域免疫球蛋白抑制因子(VISTA)。(d)中性粒细胞通过产生 ROS 和释放含有 microRNA miR-23A 和 miR-155 的微粒来诱导遗传不稳定性,这些微粒会下调参与维持核完整性的分子的表达。中性粒细胞通过产生表皮生长因子 (EGF)、肝细胞生长因子 (HGF)和血小板衍生生长因子 (PDGF)来维持肿瘤增殖,释放含有高迁移率族蛋白 B1 (HMGB1),激活癌细胞中的 Toll 样受体 9 (TLR9)、中性粒细胞弹性蛋白酶 (NE)和基质金属蛋白酶9 (MMP9),从而激活整合素信号触发癌细胞增殖。中性粒细胞通过释放促血管生成因子 BV8、S100,激活细胞外基质中的血管内皮生长因子 A (VEGFA)和MMP9来维持肿瘤血管生成。G-CSFR,G-CSF受体;GM-CSFR,GM-CSF受体;ICAM1,细胞间粘附分子1;RTK,受体酪氨酸激酶;TAN,肿瘤相关中性粒细胞;TGFβR,TGFβ受体。
中性粒细胞表达高水平的趋化因子受体CXCR1和CXCR2,它们在向TME募集中起主要作用,CXC趋化因子配体(例如,CXCL1、CXCL2、CXCL5、CXCL6和CXCL8(也称为IL-8))在肿瘤细胞、肿瘤浸润性白细胞、内皮细胞和成纤维细胞中表达。除趋化因子外,炎症细胞因子(例如,IL-17、IL-1β和肿瘤坏死因子 (TNF))与癌症中的中性粒细胞动员和募集有关。这些细胞因子是炎症回路的一部分,导致 G-CSF 的产生以及随后骨髓中中性粒细胞的形成和动员。此外,IL-1β和G-CSF显着延长中性粒细胞的存活时间。除了这些分子外,肿瘤衍生的氧固醇和补体成分过敏毒素C5a 已被证明有助于小鼠肿瘤中的中性粒细胞募集。
肿瘤中,中性粒细胞的动力学和寿命仍有待充分阐明。活体多光子成像显示,在头颈癌移植模型中,中性粒细胞在肿瘤细胞注射后 3 小时内浸润肿瘤,并在 TME 中持续长达3天。有趣的是,与肿瘤周围的中性粒细胞相比,肿瘤内中性粒细胞的运动性降低。在癌症发展的早期,与从无肿瘤个体中分离的中性粒细胞相比,从荷瘤小鼠和癌症患者中分离出的中性粒细胞,通过嘌呤能受体 P2Y 1和 P2Y 2,介导ATP 信号传导通路,促进肿瘤细胞的迁移。因此,中性粒细胞在癌症发展和进展过程中会发生动态变化。
据报道,中性粒细胞在转移性生态位中积累,其中癌细胞和基质细胞表达 G-CSF、CXCL1 和CXCL2促进了中性粒细胞的募集(图 1b)。在乳腺癌的原位移植模型和致癌基因驱动的乳腺癌发生的GEMM中,中性粒细胞的动员受到非典型趋化因子受体 2 (ACKR2)的调节,ACKR2 是炎症性 CC 趋化因子的诱饵和清道夫受体,表达于早期造血前体。该分子在小鼠体内的遗传缺陷增加了造血祖细胞中炎症性CC趋化因子受体1(CCR1)、CCR2和CCR5的表达,从而加速了中性粒细胞的成熟速度、动员和活化,从而抑制了转移。在乳腺癌患者中,发现 ACKR2 的表达与疾病的分期呈负相关。然而,ACKR2 也由非肿瘤和肿瘤乳腺上皮细胞表达,并且在这种肿瘤中造血与肿瘤细胞表达的相对重要性仍有待评估。
因此,在临床前小鼠模型和人类研究中获得的结果表明,中性粒细胞向肿瘤组织的募集和存活涉及骨髓生成的上游调节以及趋化因子、细胞因子、G-CSF 和补体成分的复杂网络。
在稳态条件下,循环和组织中性粒细胞表现出多样性,其表型和功能异质性由成熟和衰老以及来自组织微环境的改变而改变。昼夜节律振荡和衰老会影响中性粒细胞蛋白质组,包括趋化因子受体、模式识别受体和参与粘附、炎性体和水泡运输的分子,以及中性粒细胞胞的产生和迁移能力。在循环中,从骨髓中新释放的NM的特点是 CD62L 和 CXCR2 高表达,而 CXCR4 低表达(方框2)。NM在夜间和清晨释放,并在zeitgeber 时间(ZT)(即 12 小时光照 - 12 小时黑暗循环开始后 13 小时)占主导地位。中性粒细胞衰老过程是一个真正的昼夜节律过程。在 6-8 小时内,CD62L 的表达显着降低,NA以CXCR4和CD11b的高表达和超分节细胞核为特征,在ZT5(即开灯后5小时)占主导地位。这些表型变异有利于中性粒细胞清除,并表明中性粒细胞依赖性免疫和炎症反应随着时间的推移不稳定,且可能在昼夜周期中波动。与这一假设一致,与NM相比,NA显示减少了向发炎组织的迁移。
关于老化的中性粒细胞产生NETs的能力,现有的研究结果是相互矛盾的。这些明显相互矛盾的发现可能反映了用于富集NA的不同方法(即,通过注射抗体来阻止 P-选择素和 E-选择素或在未处理的小鼠中在 ZT5 处分离中性粒细胞来预防中性粒细胞外渗)。此外,在稳态条件下,循环中性粒细胞经历稳态脱粒,并在穿透组织之前失去形成NET的能力,从而限制了它们对组织的破坏潜力。这一过程由细胞内在机制驱动,该机制控制由 BMAL1 诱导的 CXCL2 的昼夜节律表达,正如在中性粒细胞老化中所观察到的那样(见上文)。因此,在中性粒细胞中,该调控机制整合昼夜节律程序中,从而保护宿主免受过度炎症反应。
除了NM和NA之外,循环中性粒细胞的单细胞RNA测序(scRNA-seq)分析还鉴明了NISG,它的特征在于表达干扰素相关基因。这种中性粒细胞亚群存在于小鼠和人类中,可以代表一群准备抵抗感染的中性粒细胞。有趣的是,在肿瘤中也观察到类似的中性粒细胞亚群(见下文)(框 2)。
在组织内,中性粒细胞可以承担重要的稳态功能并获得特定的免疫调节特性,如淋巴结和脾脏。在稳态条件下,表达主要组织相容性复合物(MHC)II类分子的中性粒细胞存在于靠近T细胞的淋巴结中,表明其作为抗原呈递细胞(APC)的作用。存在于脾脏边缘区域的中性粒细胞通过 B 细胞激活因子(BAFF)、增殖诱导配体(APRIL)和IL-21的表达激活B细胞来促进免疫球蛋白类别转换和抗体产生。因此,在稳态中,中性粒细胞表现出以前未预料到的异质性,并被整合到免疫调节回路中。在单核吞噬细胞中,源自胚胎前体的那些细胞主要执行稳态功能,而源自循环单核细胞的巨噬细胞在出生后的主要功能是对损伤和炎症作出反应,这些细胞的可塑性是多样性的主要驱动力。然而,没有证据表明存在着个体遗传学上不同的中性粒细胞,或存在着上面说到的这些严格定义的子集。因此可以推测,中性粒细胞多样性是响应分化和环境信号的可塑性的结果。癌症已成为中性粒细胞可塑性和多样性的范例,由中性粒细胞成熟阶段、对组织线索的反应和癌症进展产生(方框 2)。中性粒细胞分化和成熟轨迹在荷瘤小鼠中发生了深刻的改变。在患有晚期瘤形成的小鼠中,具有免疫抑制特性的未成熟骨髓细胞出现在循环、原发性肿瘤和转移灶中(方框2)。同样,早期单能中性粒细胞祖细胞(NePs)(方框1)被发现在黑色素瘤移植小鼠模型的骨髓和外周积聚,并且在黑色素瘤患者的血液中发现了类似的细胞亚群(CD66b+ ;CD117+ ;CD34 +/-)。在健康人和非荷瘤小鼠中,NeP分别占所有循环CD45+细胞的比例分别为1%和0.02%,NeP比例在黑色素瘤患者中增加到3-9%,在荷瘤小鼠中增加到0.2%。尽管这些祖细胞不对应于NM的一个子集,但它们确实有助于在肿瘤患者和荷瘤小鼠中发现中性粒细胞的多样性。
在乳腺癌小鼠和无肿瘤小鼠的脾脏和血液中,中性粒细胞的转录组学分析揭示了来自携带肿瘤小鼠的中性粒细胞转录程序的改变,导致免疫抑制表型,其特征是产生活性氧(ROS)、一氧化氮(NO)和精氨酸酶 2 (ARG2),具有抑制离体T细胞增殖的潜力(图1c)。在人类和小鼠肺癌中,肿瘤浸润性髓细胞的scRNA-seq 分析显示,TAN 形成了一个连续的表型状态,在人类和小鼠中可分别分解为5个和6个细胞亚群。这些细胞亚群中的三个基因表达模块在人和小鼠之间是保守的,包括一个表达典型中性粒细胞标志物(例如,基质金属蛋白酶9(MMP9)、S100A8和S100A9)的模块,一个表达与肿瘤炎症和生长有关的分子的模块。例如,CC-趋化因子配体3(CCL3)和巨噬细胞集落刺激因子1(CSF1))以及具有显示 I 型干扰素反应基因强表达的细胞数量有限的模块(例如,干扰素调节因子 7 ( IRF7 )和干扰素诱导的蛋白质与四三肽重复1(IFIT1))。
对TAN的分析揭示了TME中存在的信号如何塑造它们的功能。在由致癌Kras诱导的肺腺癌GEMM和肺癌和间皮瘤的移植模型中,发现转化生长因子-β(TGFβ)使中性粒细胞功能向促肿瘤方向极化,TANs具有高表达ARG1、CCL17和CXCL14和CXCL10、CXCL13、CCL6、TNF 和细胞间粘附分子1(ICAM1)的低表达。镜像用于极化巨噬细胞的M1-M2命名法、N1和N2已分别用于指代抗肿瘤和促肿瘤中性粒细胞(方框2)。然而,在3-MCA诱导的原发性肉瘤中,TAN 表现为 N1 和 N2 之间的混合表型。
与TGFβ相比,干扰素-β(IFNβ)、IFNγ和GM-CSF的组合,驱动中性粒细胞进入抗肿瘤状态(图 2)。在早期非小细胞肺癌(NSCLC)中,已显示IFNγ和GM-CSF驱动表达共刺激分子OX40配体(OX40L)、CD86的APC样MHCII+中性粒细胞的分化和4-1BB配体(4-1BBL;也称为TNFSF9)(图2a)。在人类头颈癌中观察到类似的人类白细胞抗原-DR(HLA-DR)+中性粒细胞群,在空间上与活化的 T 细胞相关。在癌变早期,TAN是介导抗肿瘤抗性的细胞网络的一部分,而疾病进展与将这些细胞置于免疫抑制、促肿瘤状态的功能开关有关。
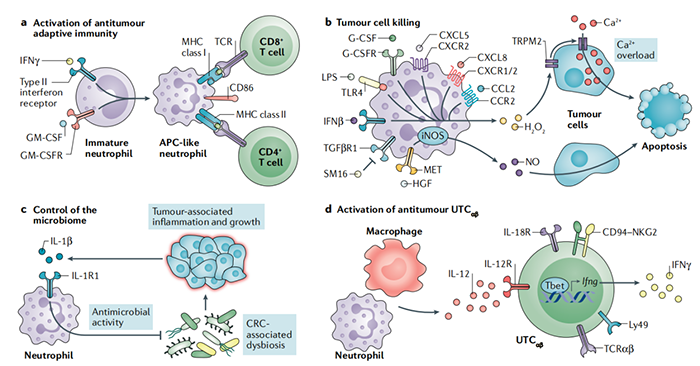
图 2:中性粒细胞的抗肿瘤潜力。中性粒细胞参与不同的抗肿瘤耐药机制,包括激活 T 细胞依赖性抗肿瘤免疫、针对肿瘤细胞的直接细胞毒活性或抗菌活性。(a)存在于肿瘤微环境中的干扰素-γ(IFNγ)和粒细胞-巨噬细胞集落刺激因子(GM-CSF),促进未成熟中性粒细胞成熟,并促进中性粒细胞表达主要组织相容性复合体(MHC)I类和II类分子以及共刺激分子CD86、4-1BB配体(4-1BBL)和OX40配体(OX40L)的抗原呈递细胞(APC)。(b)不同的刺激物,如粒细胞集落刺激因子(G-CSF)、CXC-趋化因子配体8(CXCL8)、CXCL5和CC-趋化因子配体2(CCL2)、脂多糖(LPS)和IFNβ,促进氧化爆发以及在中性粒细胞中产生过氧化氢(H2O2)。通过转化生长因子-β受体(TGFβR)(与小分子抑制剂SM16),阻断信号传导可增强H2O2的产生。反过来,H2O2触发肿瘤细胞中的细胞内信号通路,导致非选择性阳离子通道瞬时受体电位阳离子通道激活,亚家族M成员2(TRPM2)的激活和打开,从而诱导致命的钙(Ca2+)流入癌症细胞。肝细胞生长因子(HGF)作用于中性粒细胞表达的HGF受体(HGFR;也称为MET),并促进诱导型一氧化氮合酶(iNOS)的表达;反过来,iNOS会诱导一氧化氮(NO)的释放,从而杀死肿瘤细胞。(c)在结直肠癌(CRC)中,通过中性粒细胞中的1型白细胞介素(IL-1)受体(IL-1R1)发出信号可增强其抗菌活性,从而限制细菌驱动的炎症和CRC发展。(d)中性粒细胞与巨噬细胞和 CD4 – CD8 – TCRαβ +双阴性非常规 T 细胞(UTCαβ)进行三方相互作用。中性粒细胞促进了巨噬细胞产生IL-12,进而促进UTC αβ的极化1型免疫反应和IFNγ的产生。这些细胞的特点是表达T细胞受体αβ链(TCRαβ)、IL-12R、IL-18R、与其先天样表型相关的分子(例如,Ly49和CD94-NK细胞受体G2(NKG2))和干扰素γ 15。CCR2,CC-趋化因子受体 2;CXCR,CXC-趋化因子受体;G-CSFR,G-CSF受体;GM-CSFR,GM-CSF受体;TLR4,Toll 样受体 4。
来自小鼠模型和患者的证据强烈表明,中性粒细胞是许多类型癌症中促肿瘤炎症的重要组成部分(图1d)。为了支持这一点,抗体介导的中性粒细胞耗竭(有关中性粒细胞耗竭策略及其局限性的讨论见方框3)可防止GEMM中的原发性癌发生和转移,并抑制移植小鼠模型中的肿瘤生长。在TME中,TAN已被证明会影响上皮遗传不稳定性、肿瘤细胞增殖、血管生成、组织重塑和抑制先天性和适应性淋巴细胞介导的免疫。产生大量ROS是中性粒细胞的基本特性。在癌症中,中性粒细胞衍生的ROS与上皮细胞中的DNA损伤和遗传不稳定性有关。然而,不依赖ROS的诱导DNA损伤的机制也存在,包括中性粒细胞,它将特定的促炎症microRNAs(即miR-23A和miR-155)送入肠上皮细胞,通过下调核包膜蛋白lamin B1和RAD51(一种同源重组途径的调节器)促进DNA双链断裂的积累。
中性粒细胞可以表达许多与肿瘤生长和进展相关的细胞因子和生长因子,包括表皮生长因子(EGF)、肝细胞生长因子(HGF)和血小板衍生生长因子(PDGF)。在由致癌Kras诱导的肺腺癌GEMM中,肿瘤负荷因中性粒细胞弹性蛋白酶(NE)的遗传缺陷而显着降低,这与肿瘤细胞增殖的减少有关。在体外,NE通过降解胰岛素受体底物1(IRS1),激活人和小鼠肺癌细胞的增殖,从而促进 PI3K 和 PDGF 受体(PDGFR)之间的相互作用。在不同来源的上皮细胞和肿瘤细胞中,也可观察到NE 的这种体外有丝分裂。
中性粒细胞通过产生促血管生成因子(包括BV8、MMP9和血管内皮生长因子A(VEGFA)在促进肿瘤血管生成中发挥重要作用(图 1d)。在细胞外基质中,TAN衍生的MMP9诱导VEGFA的释放和激活以及随后的血管生成,而BV8诱导了骨髓细胞的动员并充当内皮细胞的有丝分裂原。中性粒细胞衍生的BV8与抗VEGF治疗的抗性有关,并且G-CSF或IL-17的抑制增加了抗VEGF的治疗效果。总的来说,这些研究支持中性粒细胞在肿瘤发生过程中初始血管生成转换中的作用。
NETs可在不同的肿瘤类型(即肝癌、乳腺癌、肠癌和胃癌)中观察到,它们的产生已被证明是由缺氧、补体或脂肪酸驱动的。NET相关分子如高迁移率族蛋白B1(HMGB1)、NE和MMP9 可以诱导癌细胞的增殖(图 1d)。在肺转移的小鼠模型中,持续的肺部炎症促进了 NETs 的形成,进而诱导了休眠癌细胞的增殖。实际上,NET 中所含的 NE 和 MMP9 对细胞外基质成分层粘连蛋白的蛋白水解重塑诱导了新表位的产生,该表位通过 α3β1 整合素激活触发了休眠癌细胞的增殖。此外,在NETs促进了循环肿瘤细胞(CTC)的远处转移及种植,在体内施用 DNase 可消除 NETs这种影响。在脾内注射肺癌和结肠癌细胞诱导的肝转移小鼠模型中,活体显微镜检查显示,在用 DNase 94处理的小鼠中,CTC 与肝窦的粘附性降低。体外研究表明,NETs 中的 HMGB1 诱导癌细胞的 TLR9 通路激活,促进其增殖、迁移和侵袭能力。此外,NET 中含有的髓过氧化物酶(MPO)促进了过氧化氢(H2O2)诱导的内皮细胞中 TLR4 依赖性促血管生成反应,其特点是增殖和运动。因此,NETs 可以通过驱动血管生成、细胞外基质重塑和肿瘤细胞增殖来参与促肿瘤炎症。中性粒细胞的促肿瘤功能发生在远处解剖部位的传播和播种的多步骤过程中。据报道,中性粒细胞在肺和肝等多种器官中准备转移生态位。此外,据报道,中性粒细胞与血流中的 CTC 结合并有利于外渗和随后的转移性生长(图 1b)。癌症的GEMM(包括在角蛋白14(K14 )–Cre中诱导的乳腺肿瘤;E-钙粘蛋白(Cdh1)fl/fl;在villin Cre ER中诱导的Trp53 fl/fl(KEP)小鼠,小鼠乳腺肿瘤病毒(MMTV)-多瘤中间T抗原(PyMT)小鼠和结肠直肠癌(CRC);KrasG12D/+;Trp53fl/fl;Rosa26N1icd/+ (KPN)小鼠)提供了对中性粒细胞介导的促进转移分子机制的见解。在KEP小鼠中,具有免疫抑制活性的中性粒细胞的系统积累与自发性肺转移的形成增加有关。从机制上讲,癌细胞中 p53 的缺失促进了WNT配体的分泌,从而刺激巨噬细胞产生 IL-1β。反过来,IL-1β 激活 γδ T 细胞产生 IL-17,驱动中性粒细胞在循环和肺中积聚,并促进转移瘤的形成。由于IL-17在信号通路中位于G-CSF的上游,它增加了中性粒细胞的形成,并使其极化为具有免疫抑制活性的细胞。事实上,G-CSF可以促进免疫抑制性中性粒细胞的产生,并且G-CSF在KEP小鼠体内中和逆转了中性粒细胞的免疫抑制表型。因此,来自TH17细胞或γδ T细胞的IL-17参与了肿瘤患者体内的中性粒细胞增多过程,并驱动了中性粒细胞的促肿瘤活动。在肺的转移前生态位中,中性粒细胞产生促进转移起始细胞外渗和生长的因子,包括促血管生成分子BV8和MMP9(在MMTV-PyMT小鼠中观察到)、化学吸引剂S100A8和S100A9(在KEP小鼠中观察到)、介导血栓软骨素1(TSP1.)裂解的蛋白酶NE和猫肝素G。其结果是细胞外基质的降解和 TSP1 介导的抑制肿瘤细胞生长(在 MMTV-PyMT 小鼠中观察到),以及促炎细胞因子 IL-1β 和中性粒细胞趋化因子白三烯 B4(LTB4)(在 MMTV-PyMT 小鼠中观察到)(图 1d)。 两种单克隆抗体(mAb),RB6-8C5和1A8,已广泛用于消耗小鼠的嗜中性粒细胞。mAb RB6-8C5的特点是与粒细胞分化抗原(Gr1)相互作用,可与淋巴细胞抗原6G(Ly6G)和Ly6C分子相互作用,促进中性粒细胞和其他表达Ly6C的细胞(包括单核细胞)的消耗。相比之下,Ly6G 特异性 mAb 1A8 会导致嗜中性粒细胞的排他性消耗。需要注意的是,使用相同的mAbs监测耗竭的效果是不可靠的,因为目标抗原会被耗竭抗体 "掩盖"。
两种单克隆抗体(mAb),RB6-8C5和1A8,已广泛用于消耗小鼠的嗜中性粒细胞。mAb RB6-8C5的特点是与粒细胞分化抗原(Gr1)相互作用,可与淋巴细胞抗原6G(Ly6G)和Ly6C分子相互作用,促进中性粒细胞和其他表达Ly6C的细胞(包括单核细胞)的消耗。相比之下,Ly6G 特异性 mAb 1A8 会导致嗜中性粒细胞的排他性消耗。需要注意的是,使用相同的mAbs监测耗竭的效果是不可靠的,因为目标抗原会被耗竭抗体 "掩盖"。
因此,应通过使用替代抗体(如Ly6B)来评估耗竭效果。一些研究(包括一篇预印本中描述的研究)报告说,持续施用Ly6G特异性抗体会导致初始FVB/N和BALB/c小鼠中嗜中性粒细胞的有效消耗,但不会在C57BL/6J小鼠中起到同样作用。造成这种差异的机制尚未确定,可能取决于造血功能或抗体依赖性中性粒细胞被巨噬细胞吞噬的差异。数据表明,在C57BL/6J小鼠中联合使用1A8和一个次级大鼠抗体,会导致体内中性粒细胞耗竭的效力和持续时间增加。
遗传策略是一种有价值的工具,可以克服mAb诱导的中性粒细胞耗竭限制。遗传性中性粒细胞减少症的模型利用了参与中性粒细胞发育的分子的重要性(例如集落刺激因子3(Csf3)-/-、CSF3受体(Csf3r)-/-和生长因子独立1(Gfi)-/-小鼠)。然而,这些模型也有局限性,因为遗传缺陷会影响其他细胞类型(即单核细胞)的发育。条件性基因缺陷可以代表一种更复杂的工具来实现特定和持久的中性粒细胞消耗。例如,骨髓腔(LysM-Cre 小鼠)中抗凋亡蛋白 MCL1 的消融会导致中性粒细胞缺乏。然而,需要注意的是,使用LysM–Cre几乎完全耗尽循环和组织中性粒细胞 (>98%);Mcl1 fl/fl小鼠需要高水平的 Cre 介导的Mcl1缺失,为此可能需要 Cre 重组酶的双等位基因表达。中性粒细胞中Ly6G表达的高度特异性使得靶向该位点成为一种很有前景的策略。然而,预印本中的结果显示,将Ly6g-Cre与Cre诱导的白喉毒素受体(iDTR)结合使用(制成Ly6gDTR小鼠),对耗尽中性粒细胞的效率不高,因为这些细胞对白喉有抵抗力。相比之下,S100A8 DTR小鼠表现出完全的中性粒细胞耗竭,这表明在中性粒细胞发育过程中S100A8表达发生在祖细胞的形成过程中。还有一个评估中性粒细胞在肿瘤中功能的策略在概念上是不同的,即通过对CXC-化学因子受体2(CXCR2)(Cxcr2-/-小鼠)的基因消融来评估。然而,由于CXCR2在其他骨髓细胞和非免疫细胞(例如癌细胞)中的表达,这种方法存在很大的局限性。为了明确证明中性粒细胞参与肿瘤进展,应使用不同的中性粒细胞耗竭方法,并评估外周血、远处器官和肿瘤中中性粒细胞耗竭的程度。
NI和NM可以表达一系列能够抑制先天性和适应性淋巴细胞功能的介质,包括ROS、活性氮中间体(RNI)、ARG1、前列腺素和免疫检查点的配体。
嗜中性粒细胞衍生的 ROS 与抑制癌症中的 T 细胞活化有关(图1c),特别是在晚期肿瘤中。在乳腺癌移植小鼠模型中,TME中的葡萄糖剥夺触发了中性粒细胞的代谢转换,导致线粒体脂肪酸氧化增强、ROS产生更多,从而抑制T细胞。除ROS外,中性粒细胞还可以通过诱导型NO合酶(iNOS)依赖性产生NO,抑制T细胞活化(图1)。
TAN产生的ARG1降低了TME中L-精氨酸的可用性,TME控制 T 细胞代谢并促进 T 细胞存活。反过来,这会导致 T 细胞功能障碍和 T 细胞介导的抗肿瘤免疫发生改变。TANs 对 ARG1的表达可以由 TGFβ 驱动(图 1c)。值得一提的是,在肾细胞癌和晚期NSCLC中,中性粒细胞产生 ARG1 已被证明会阻碍人类癌症中的 T 细胞反应。
内质网(ER)应激与癌症中髓细胞(包括来自NSCLC和头颈癌患者的中性粒细胞)的脂质代谢改变、病理激活和免疫抑制活性有关。在NSCLC患者、由致癌性Kras加上Trp53突变诱导的胰腺癌GEMM和可移植的淋巴瘤小鼠模型中,免疫抑制性中性粒细胞的特征在于其低密度,以及ER应激反应相关的基因表达增加(例如,C/EBP-同源蛋白(CHOP; 也称为DDIT3)、X-box 结合蛋白1(XBP1)、结合免疫球蛋白(BIP;也称为HSPA5)和 AMP 依赖性转录因子(ATF4))。
中性粒细胞中 ER 应激的诱导上调了凝集素样氧化的 LDL 受体 1(LOX1)的表达,LOX1 是一种参与脂质代谢的清道夫受体,同时具有有效的免疫抑制活性。在 NSCLC 和头颈癌的患者中,与 LOX1 –中性粒细胞相比,LOX1 +中性粒细胞表现出更高的 ROS 和 ARG1 表达,中性粒细胞群体被定义为具有免疫抑制活性。除了LOX1,存在于荷瘤小鼠和头颈部肿瘤、乳腺肿瘤和肺肿瘤患者中的免疫抑制性中性粒细胞,表现出其他参与脂质运输的蛋白质的上调,例如 CD36 和脂肪酸转运蛋白2(FATP2)。
尽管 LOX1 在中性粒细胞免疫抑制活性中的作用仍有待确定,但表达 FATP2 的中性粒细胞对花生四烯酸的摄取增加推动了前列腺素 E 2 (PGE 2 )的生物合成和随后的免疫抑制(图 1c )。因此,在荷瘤小鼠中施用 FATP2 抑制剂可降低中性粒细胞的免疫抑制活性和肿瘤生长。这些结果可能为针对中性粒细胞脂质代谢的新策略打下基础。
中性粒细胞可以表达激活 T 细胞免疫检查点的配体(图 3a),程序性细胞死亡1配体1(PDL1)被小鼠中的缺氧诱导因子1α(HIF1α)通路和人类中的炎性细胞因子(例如,IL-6、IFNγ和GM-CSF)所诱导。已在人类肝细胞癌和胃癌中鉴定出表达PDL1的中性粒细胞,并发现其具有预后意义。因此,中性粒细胞是表达PDL1的骨髓和基质细胞网络的一部分,可驱动免疫检查点参与和T细胞耗竭。然而,需要进一步的研究来评估PDL1在不同癌症类型的中性粒细胞中的表达和功能。
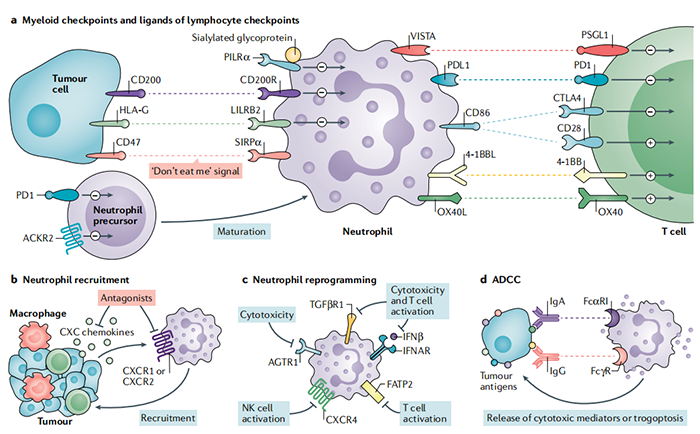
图 3:中性粒细胞的靶向治疗。(a)中性粒细胞表达一组髓细胞检查点,包括信号调节蛋白-α(SIRPα)、CD200 受体 (CD200R)、白细胞免疫球蛋白样受体 B2 (LILRB2)、配对免疫球蛋白样 2 型受体-α(PILRα)和中性粒细胞前体、程序性细胞死亡1(PD1)和非典型趋化因子受体2(ACKR2)。已在临床前模型中确立了针对中性粒细胞的 SIRPα、LILRB2 和 ACKR2 的重要性。然而,阻断CD200R、PILRα和PD1的潜在抗肿瘤作用没有得到类似的证明。中性粒细胞还表达一组淋巴细胞检查点的配体(即V域免疫球蛋白T细胞活化抑制剂(VISTA)、PD1配体1(PDL1)、CD86、4-1BB 配体(4-1BBL)和OX40配体(OX40L)),代表了限制中性粒细胞介导的癌症免疫抑制过程的潜在靶点。与T细胞表达的同族受体(分别是P-选择素糖蛋白配体1(PSGL1)、PD1、细胞毒性T淋巴细胞相关抗原4(CTLA4)、4-1BB和OX40)相互作用,向T细胞传递正(+)或负(-)信号,取决于特定的受体-配体配对。(b)抑制CXC-趋化因子受体1(CXCR1)或CXCR2会抑制癌症中免疫抑制性中性粒细胞的募集。(c)阻断转化生长因子-β受体(TGFβR)、干扰素-β(IFNβ)信号传导或血管紧张素II 1型受体(AGTR1)的拮抗作用可以增加中性粒细胞对癌细胞的细胞毒活性。CXCR4阻断增加了中性粒细胞产生白细胞介素18(IL-18)和激活自然杀伤(NK)细胞。最后,中性粒细胞的免疫抑制作用可以通过阻断脂肪酸转运蛋白2(FATP2)来削弱,该蛋白响应花生四烯酸,诱导前列腺素 E 2 (PGE 2 )的合成。(d )中性粒细胞表达免疫球蛋白G(IgG)Fc受体(Fcγ受体(FcγR))和IgA Fc受体(FcαRI),并通过抗体依赖性细胞毒作用(ADCC)过程参与消除抗体光化的癌症细胞。HLA-G,人白细胞抗原-G;IFNAR,IFNα/β受体。
上述结果和临床相关证据表明,中性粒细胞是许多小鼠和人类肿瘤中促肿瘤炎症和免疫抑制的重要组成部分。与这些观察结果明显相反,在一些研究中,中性粒细胞也被证明在体外和体内介导抗肿瘤抗性,这表明中性粒细胞具有双重潜力。
大量中性粒细胞的募集和激活可导致抗肿瘤活性是早就知道的事实。中性粒细胞可以通过直接接触细胞和产生ROS两种方式杀死肿瘤细胞(图2b)。ROS介导的杀伤涉及瞬时受体电位阳离子通道,M亚家族成员2(TRPM2)是一种H2O2依赖性通道,可诱导钙(Ca2+)致死流入靶细胞(图2b)。TRPM2在经历上皮间质转化(EMT)的癌细胞中表达上调,这也与CXCL2分泌的增加有关,这表明除了触发凋亡级联反应外,TRPM2还维持中性粒细胞的募集。
中性粒细胞杀伤武器包括NO、TNF相关凋亡诱导配体(TRAIL)和TNF,后者诱导中性粒细胞上的肝细胞生长因子受体(HGFR;也称为MET)的表达。在不同肿瘤细胞系移植小鼠模型(例如,Lewis 肺癌和纤维肉瘤)中的研究表明,存在于TME中的HGF诱导中性粒细胞募集和NO的产生,从而导致肿瘤细胞的凋亡。然而,在黑色素瘤移植小鼠模型中,嗜中性粒细胞中的HGF-MET信号导致了一种免疫抑制表型产生,这与抗肿瘤T细胞的有限扩增和对过继性T细胞转移和免疫检查点阻断疗法的反应降低有关。因此,在不同的肿瘤背景和治疗条件下,MET表达对中性粒细胞的影响仍有待充分阐明。
中性粒细胞在转移性生态位中的积累和激活可以通过消除癌细胞来减少转移的形成。在乳腺癌原位移植小鼠模型中,原发性肿瘤表达的G-CSF和CCL2诱导了转移前中性粒细胞的动员和活化,从而导致肿瘤细胞的ROS依赖性杀伤。抗体介导的中性粒细胞耗竭不影响原发性肿瘤的生长速度或CTC的数量,但会增加肺部的转移负担,这表明中性粒细胞在转移生态位中起作用。该结果表明原发性肿瘤和中性粒细胞之间相互作用以激活它们的抗肿瘤活性并控制转移进展。
在免疫缺陷小鼠中,将具有低自发转移潜能的人乳腺癌细胞移植到乳腺脂肪垫中,导致转移前肺中的中性粒细胞重新编程,其高细胞毒性活性与跨膜蛋白173(TMEM173;也称为STING)的表达有关。在这种情况下,与具有高转移潜力的乳腺癌细胞相比,具有低自发转移效率的乳腺癌细胞显示出CCL2的表达增加。肿瘤来源的CCL2诱导了产生IFNγ的CCR2单核细胞的招募。反过来,IFNγ上调TMEM173并增强中性粒细胞的细胞毒活性。这些观察结果突出了中性粒细胞作为效应细胞的能力。
除了介导直接杀伤外,中性粒细胞还参与T细胞依赖性抗肿瘤免疫网络。TAN已被证明可以产生包括CXCL10、CCL2、CCL3、CXCL1和CXCL2在内的趋化因子,它们可以募集T细胞以及其他白细胞。中性粒细胞可以获得APC表型,在早期肺癌中,可发现一群未成熟的CD11bCD15+hiCD10–CD16int/low中性粒细胞刺激CD4和 CD8 T 细胞的增殖。体外实验表明,TME中存在的GM-CSF和IFNγ,促进NI获得APC特征,其特征在于HLA-DR和CD86的表达以及放大抗肿瘤 T 细胞反应的能力(图 2a )。此外,从人类CRC活检标本中分离出的中性粒细胞在体外对T细胞受体(TCR)的触发反应中放大了CD8 T细胞的激活。
肠道微生物群在炎症和结直肠癌发生中发挥作用。据报道,中性粒细胞通过对单核细胞和肿瘤细胞在 TME 中产生的 IL-1 的反应在 CRC 中具有肿瘤抑制作用,这增强了中性粒细胞对抗菌肽的表达及其随后的抗菌活性(图 2c)。除CRC外,由Kras突变和Trp53缺失诱导的GEMM肺癌发生也与气道微生物群失调有关,它刺激常驻γδ T细胞产生IL-17,导致中性粒细胞增多和肿瘤生长。因此,中性粒细胞可以在控制微生物群诱导的促肿瘤炎症中发挥作用。
在3-MCA诱导的原发性肉瘤形成中,发现中性粒细胞、巨噬细胞和一组非常规T细胞(UTC)之间的三方相互作用,即CD4–CD8–TCRαβ双阴性UTC(UTC+α)建立有效的抗肿瘤免疫(图 2d)。在肉瘤发展的早期阶段,中性粒细胞通过巨噬细胞放大了IL-12的产生,这反过来促进了UTCαβ向 1 型免疫反应和IFNγ产生的极化(图 2d)。然而,需要进一步研究以确定UTCαβ作为T细胞亚群的机制,可以作为抗肿瘤效应细胞,以及它们在人类肿瘤中的存在、意义和作用。有趣的是,计算机分析表明,这种中性粒细胞依赖性抗肿瘤轴与选定的人类肿瘤相关。因此,中性粒细胞在肿瘤免疫中可以发挥双重的、似乎相反的功能。疾病阶段以及肿瘤类型和组织环境,是决定这些细胞在促进或抑制癌症方面特定作用的关键因素。在不同肿瘤类型和不同肿瘤阶段发现的炎症介质水平和性质可能决定中性粒细胞的表型。同一生长因子G-CSF可以通过刺激中性粒细胞的细胞毒性活性或获得免疫抑制活性(取决于条件)来驱动抗肿瘤和促肿瘤中性粒细胞的分化和激活,这一事实强调了相关调节途径的复杂性。为了综合关于中性粒细胞在肿瘤中双重作用的现有数据,我们推测,在肿瘤发展的早期阶段,髓细胞处于抗肿瘤状态,而疾病进展到入侵和转移则与获得亲肿瘤的免疫抑制表型有关并由其驱动。
如上所述,髓细胞生成增加是晚期肿瘤的共同特征,在癌症患者中也观察到中性粒细胞的多样性,包括肺癌、头颈癌和黑色素瘤。通过对血液样本使用飞行时间质谱流式(CyTOF)测试,确定了在黑色素瘤进展的不同阶段的CD66b中性粒细胞的不同表型。值得注意的是,末端分化的NM亚群的丰度,以CD66b、CD10、CD101和CD16的表达为特征,在肿瘤进展过程中逐渐下降,而以CD66b、CD117、CD49d和CD79b表达为特征的NI增加。然而,需要注意的是中性粒细胞不成熟与免疫抑制活性之间的关联仍然存在争议。事实上,未成熟的人类CD10–CD66b中性粒细胞促进T细胞活化,而CD10 N++M则有相反的效果。在外周血中,高中性粒细胞计数和高中性粒细胞与淋巴细胞比(NLR)与广泛实体瘤(例如,CRC、黑色素瘤和乳腺癌、前列腺癌和肺癌)患者的不良预后相关。NLR的预后意义在一项涉及项研究的荟萃分析中得到验证,该项研究涉及40,559名患者和22种实体瘤。然而,NLR在临床中的相关性仍有待证明。例如,在转移性乳腺癌患者中,发现NLR与疾病分期、中枢神经系统受累和内脏转移有关,但在多变量分析中失去了其预后意义。中性粒细胞在人类实体瘤中以可变数量存在,可以通过常规免疫组织化学(例如,通过对 CD66b 染色)和中性粒细胞转录特征来评估。一般而言,高TAN浸润与较差的预后相关。例如,在一项大型研究中,使用CIBERSORT(通过估计已知RNA转录物的相对子集进行细胞类型识别)方法,对大约18,000名具有39种不同肿瘤类型的患者的22个白细胞群进行量化,中性粒细胞特征成为最重要的负预后因素。在早期NSCLC中,TAN是最具代表性的白细胞群,与T细胞浸润呈负相关。因此,抑制T细胞介导的免疫可能是其不良临床意义的潜在机制之一。此外,对肝细胞癌活检标本的相关分析揭示了中性粒细胞的发生与血管生成之间存在关联。与上述结果明显不同的是,在某些人类肿瘤中,通过免疫组化或中性粒细胞转录特征评估的高水平的TANs与更好的预后有关。这些肿瘤包括CRC、子宫内膜癌、浸润性导管乳腺癌、低级别胶质瘤和未分化的多形性肉瘤(UPS)。在CRC中,TANs与CD8 T细胞共同定位,与单独的CD8 T细胞相比,TANs和CD8 T细胞的联合浸润与更好的预后价值有关。在UPS中,而不是在其他肉瘤中,中性粒细胞特征与I型免疫反应和更好的临床结果有关。由于UPS可能是3-MCA诱导的小鼠原发性肉瘤的人类对应物,这里的中性粒细胞可能参与由UTCαβ介导的抗肿瘤反应(图 2d)。因此,在选定的人类肿瘤中,TAN似乎可以通过直接杀死肿瘤细胞,或通过与先天性和适应性淋巴细胞参与合作网络来介导抗肿瘤抗性。总的来说,目前的数据表明,中性粒细胞及其功能在循环和肿瘤环境中的重要性可能受到组织和肿瘤环境的强烈影响。
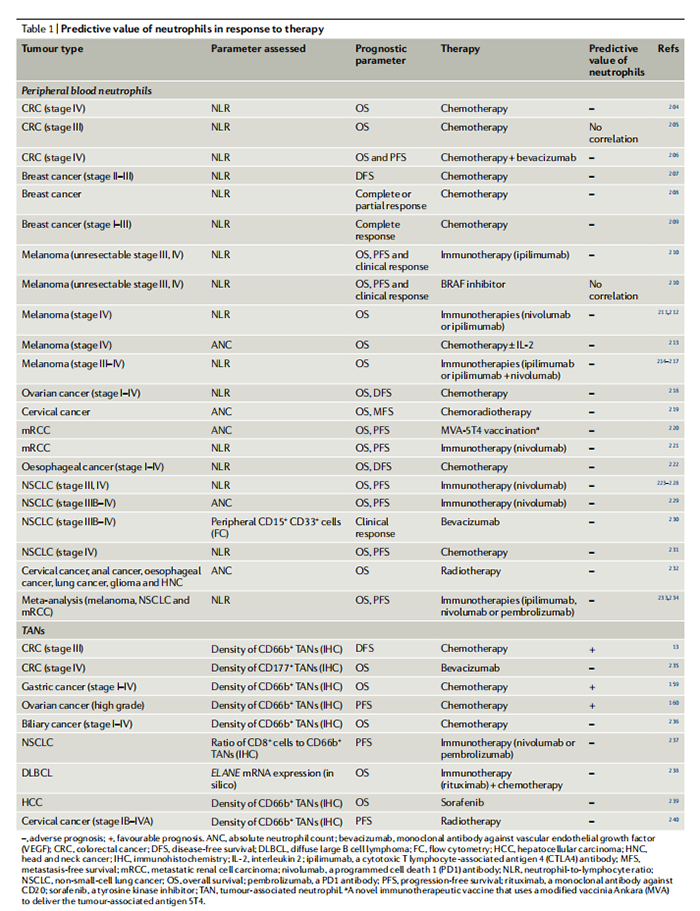
TAN浸润会影响对不同抗癌治疗方式的反应(表1)。据报道,高中性粒细胞浸润一般与化疗和放疗的反应较差有关(表1)。然而,在CRC、胃癌和高级别卵巢癌中,更高水平的 TAN 与更好的化疗反应相关。这些关于TAN对细胞减灭方案的预测价值的不一致观察可能反映了这些癌症免疫生物学的根本差异。表 1:中性粒细胞对治疗反应的预测值。-,不良预后;+,预后良好。ANC,绝对中性粒细胞计数;贝伐珠单抗,抗血管内皮生长因子(VEGF)单克隆抗体;结直肠癌;DFS,无病生存;DLBCL、弥漫性大B细胞淋巴细胞;流式细胞癌;异氢氰酸、头颈部癌;IHC、免疫组化;IL-2、白细胞介素2;细胞毒性细胞抗相关抗原4(CTLA4)抗体;MFS,无转移生存;NLR,中性粒细胞与淋巴细胞比率;NSCLC,非小细胞肺癌;OS,总生存率。外周血中性粒细胞增多和高NLR与对免疫检查点抑制剂(ICI)的不良反应有关(表 1)。如上所述,中性粒细胞表达免疫检查点的配体,包括PDL1和VISTA。在TME中表达PDL1的中性粒细胞水平高与肝细胞癌和胃癌患者的生存率低有关。因此,中性粒细胞既是ICI的目标,也是ICI的抵抗机制。总之,中性粒细胞是既定治疗方式(从化疗到ICI和介导抗体依赖性细胞毒性(ADCC)的单克隆抗体(mAbs))抗肿瘤疗效的重要决定因素。此外,包括骨髓检查点靶向策略、新的免疫检查点阻断免疫疗法和TGFβ抑制剂在内的实验性疗法将中性粒细胞作为其治疗靶点之一。
更好地理解中性粒细胞在肿瘤进展中的复杂作用将为设计治疗方法提供理论基础。特别是,剖析不同癌症类型和部位(即外周血或 TME)的中性粒细胞多样性和可塑性,对于特异性靶向治疗是一项重大挑战。如上所述,中性粒细胞表达的趋化因子受体 CXCR2 和 CXCR1 ,对于中性粒细胞被招募到TME、调节它们的激活状态和它们的昼夜震荡非常重要。根据临床前模型的结果,通过阻断CXCL8、CXCR1和/或 CXCR2 来抑制中性粒细胞募集现已进入临床评估(图 3b )。
最近的研究表明,晚期实体癌患者(1,344名患有黑色素瘤、NSCLC 和肾细胞癌的患者,以及 1,445 名患有尿路上皮癌和肾细胞癌的患者)的血清和肿瘤中CXCL8的水平较高,与中性粒细胞的肿瘤浸润增加、生存期更短、对ICI(例如,细胞程序性死亡1(PD1)抗体nivolumab,nivolumab加细胞毒性T淋巴细胞相关抗原4(CTLA4)抗体ipilimumab或PDL1抗体atezolizumab)的临床反应更低有关。全人CXCL8 mAb(BMS-986253)在晚期实体瘤患者(NCT03400332;BMS-986253联合nivolumab)或激素敏感的前列腺癌患者(NCT03689699;BMS-986253联合nivolumab和间歇性雄性激素剥夺)的临床效益正在评估之中。BMS-986253在15名转移性或不可切除的晚期实体瘤患者中进行的初步I期临床试验表明,该治疗是安全和良好的耐受性。CXCR2 抑制剂(即AZD5069、reparixin , SX-682 和 navarixin)对转移性去势抵抗性前列腺癌 (NCT03177187); AZD5069 与非甾体抗雄激素治疗 enzalutamide 联合使用)和早期乳腺癌 (NCT01861054;reparixin),转移性乳腺癌(NCT02001974)和 NCT02370238;reparixin 与化疗紫杉醇组合),转移性黑色素瘤(NCT03161431);SX- 682 与 PD1 抗体 pembrolizumab 联合使用)和 NSCLC 和 CRC(NCT03473925); navarixin 与派姆单抗联合使用)的临床效应评估正在进行中。鉴于迄今为止在炎症条件下使用趋化因子抑制剂获得的结果令人失望,评估这些药物是否确实影响 TAN 浸润和/或活化状态将很重要。重新规划TME中的中性粒细胞功能是一个挑战,对此已经有不同的解决方法被提出,包括阻断TGFβ64(图3c)。同样,据报道,在小鼠模型中靶向血管紧张素转换酶(ACE)和血管紧张素 II 1 型受体(AGTR1)、烟酰胺磷酸核糖基转移酶(NAMPT)或CXCR4可将中性粒细胞转换为抗肿瘤状态。与HIF1α 在将中性粒细胞置于促肿瘤状态中的作用一致,在Pten缺失诱导的子宫癌GEMM中,高氧和低氧的逆转激活了中性粒细胞的抗肿瘤潜力。下面,我们重点讨论另外两种方法,即ADCC和骨髓检查点,因为它们对中性粒细胞的多样性和重新编程具有重要意义。中性粒细胞与单核细胞、巨噬细胞和NK细胞共同表达Fcγ受体(FcγRs),并通过ADCC183介导肿瘤细胞消除(图3d)。在此过程中,中性粒细胞的消耗降低了针对CD52(阿仑单抗)和CD20(利妥昔单抗)的单克隆抗体在小鼠淋巴瘤中的治疗效果。人类中性粒细胞还表达免疫球蛋白A(IgA)的高亲和力受体 FcαRI(也称为 CD89),它是一种有效的 ADCC 诱导剂;与中性粒细胞引发的 FcγR 介导的 IgG 调理靶细胞的ADCC 相比,该受体的表达导致 IgA 调理癌细胞的杀伤增加。此外,发现含有人恒定区结构域的嵌合 IgA 抗 CD20 mAb 在表达功能性人 FcαRI 的转基因小鼠中,比嵌合 IgG 抗 CD20 mAb 更有效,并能防止淋巴瘤发展。
有趣的是,IgA 引发的中性粒细胞介导ADCC可以通过同时阻断 CD47 信号调节蛋白-α (SIRPα)髓细胞检查点来增强效应。在人乳腺癌细胞、内皮细胞和中性粒细胞的三维胶原培养模型中,通过用 FcαRI 抗体处理触发中性粒细胞 FcαRI 促进了 LTB4 的释放,LTB4 是中性粒细胞、IL-1β 和 TNF 的有效化学引诱物,而 LTB4 反过来通过内皮细胞产生 CXCL8 来放大中性粒细胞的募集。实际上,抗肿瘤 IgA 治疗维持了中性粒细胞的活化,并为中性粒细胞募集创造了一个放大回路。因此,FcαRI 介导的 ADCC 可能代表了一种有价值的以中性粒细胞为中心的治疗策略。
髓细胞的功能受众多负调节因子(称为检查点)的控制,这些负调节因子由嗜中性粒细胞、单核细胞和巨噬细胞表达,包括 SIRPα、CD200 受体(CD200R)、白细胞免疫球蛋白样受体 B2(LILRB2)、成对的免疫球蛋白样 2 型受体 α(PILRα)以及在中性粒细胞前体上表达的 PD1 和 ACKR2(图 3a)。临床前证据表明,中性粒细胞有助于阻断 CD47-SIRPα信号通路和 LILRB2 药物的抗肿瘤活性,而对于图 3a中呈现的其他分子,它们在中性粒细胞上的表达意义目前尚不清楚。SIRPα 由中性粒细胞、单核细胞和巨噬细胞高度表达,并通过与靶细胞上呈现的 CD47 相互作用,充当吞噬检查点。CD47 在癌细胞上过度表达,使其对髓细胞具有抗性。有趣的是,在基于抗体的治疗过程中,CD47-SIRPα 检查点阻断增加了癌细胞(包括非霍奇金淋巴瘤细胞、黑色素瘤细胞和乳腺癌细胞)的消除,并增强了中性粒细胞在体外对曲妥珠单抗调理的乳腺癌细胞的细胞毒活性。此外,在表达人 SIRPα 的转基因小鼠中,当与抗肿瘤 mAb(例如,抗 CD20、抗 HER2 或抗 EGFR mAb)结合时,SIRPα mAb 的施用增加了巨噬细胞和中性粒细胞对肿瘤细胞的杀伤。重要的是,在这种情况下抗肿瘤活性取决于中性粒细胞的活性。据报道,抗 CD47 与抗 CD20 联用在非霍奇金淋巴瘤患者中具有显着的抗肿瘤活性。然而,中性粒细胞在这种情况下的意义,以及更普遍地在阻断CD47-SIRPα下游的适应性免疫的激活和定向中的意义,仍有待确定。LILRB2 由包括嗜中性粒细胞在内的髓细胞表达,并作为细胞活化的负调节因子。LILRB2 与经典和非经典 HLA I 类分子结合,并在其细胞质尾部包含基于免疫受体酪氨酸的抑制性受体基序(ITIM)。LILRB2 的一种配体 HLA-G 对中性粒细胞具有激活作用,这抑制了它们的吞噬活性和 ROS 的产生。在肺癌小鼠模型中,LILRB2 阻断剂与抗 PDL1 联合使用可抑制免疫抑制性中性粒细胞的浸润并显着促进抗肿瘤免疫。ACKR2在造血前体细胞上表达,在NM上几乎不存在。ACKR2的遗传缺失导致具有抗肿瘤特性的中性粒细胞动员增加,其特征在于 ROS 介导的对癌细胞细胞毒活性。因此,尽管靶向ACKR2可能释放CC-化学因子介导的外围淋巴细胞和单核细胞动员,但它也可能释放中性粒细胞的效应功能。通过研究CD47–SIRPα 信号轴的功能获得的证据表明,阻断髓细胞检查点可通过引发 T 细胞依赖性免疫(包括 CD8 +细胞毒性 T细胞)来释放适应性免疫反应。这表明靶向中性粒细胞检查点可能代表癌症免疫治疗的新前沿。然而,并非所有髓细胞检查点都由中性粒细胞表达,事实上,一些负调节因子(例如,常见的淋巴管内皮和血管内皮受体 1 ( CLEVER1 ))仅存在于巨噬细胞上。因此,随着这些分子作为治疗靶点进入临床领域,仔细评估中性粒细胞数量、多样性和功能作为抗肿瘤活性的候选相关因素将非常重要。
长期以来,中性粒细胞在癌症中的存在和意义一直被忽视。应用严格的方法来量化它们对 TME 的影响并分析它们的多样性和可塑性,揭示了对 TAN 免疫生物学的新功能。因此,TAN 已成为小鼠和人类肿瘤生态位的重要组成部分。目前关于中性粒细胞在癌症中的作用,是基于使用小鼠抗体的中性粒细胞耗竭研究,或TME 及外周血中发现的中性粒细胞数量与癌症患者存活率之间的相关性分析。
然而,在致癌物诱导的癌症和GEMM中,理想的实验方法是使用基因靶向方法进行中性粒细胞消耗,消除特定中性粒细胞功能,而不是将肿瘤细胞系移植小鼠模型中。然而,这种理想的实验方法需要确定中性粒细胞在不同肿瘤中的具体作用,意味着需要在单细胞水平上检验 TAN 的多样性,并将这种复杂的信息与中性粒细胞功能以及患者预后和对治疗的反应联系起来,这是该领域存在的重要挑战。中性粒细胞和相关髓源性抑制细胞(MDSC)种群的多样性的当前命名法可能会让该领域内外的研究人员感到困惑(方框 2)。然而,即使是不完美的命名法也可能具有一些启发的价值。因此,我们呼吁按照以前对ILCs、巨噬细胞、IL-1和其他细胞类型和分子进行的工作思路,为中性粒细胞的可塑性和多样性制定一个临时的命名法,以达成共识。处于不同分化和激活阶段的髓细胞,代表全身和局部 TME 免疫抑制的水平。剖析不同肿瘤背景下单核细胞与中性粒细胞分化途径的重要性和多样性,并将其与一般的免疫学景观相结合,可能可以为个性化治疗方法打下基础。
TANs可以成为抗肿瘤耐药途径的一部分。中性粒细胞表达髓细胞检查点,现在有证据表明,靶向负调节因子 CD47 并释放髓细胞功能可以带来临床治疗益处。作者推测,在那些有证据表明中性粒细胞具有保护作用的肿瘤类型(例如,肉瘤和结直肠癌)以及目前对免疫疗法有抵抗力的患者中,利用中性粒细胞的抗肿瘤潜力可能代表了一种值得追求的策略,以补充既定的以T细胞为中心的治疗手段。