大多数哺乳动物抗体的IgG包含两条重链,两条轻链,分子量约150KD。科学家在鲨鱼和骆驼发现了没有轻链,只有重链的IgG(heavy-chain only antibodies, HCAb)。基于HCAb进一步开发了单域抗体(single-domain antibody,sdAb),称之为纳米抗体或者VHH。
纳米抗体有其优势,比如具有抗体特异性,分子量小(经典抗体的1/10)组织穿透性好,可以使用大肠杆菌表达,生产成本低,易溶解可以做口服制剂。当然也有缺点,半衰期短。
Ablynx研发的anti-VWF纳米抗体(caplacizumab)已被批准用于血小板减少性紫癜。
纳米抗体开发常用靶点
目前纳米抗体的靶点主要是肿瘤细胞,免疫细胞等的胞外靶点(配体,受体,跨膜蛋白),如EGFR1 (HER1), EGFR2 (HER2),VEGFR2, c-Met,CXCR7等。
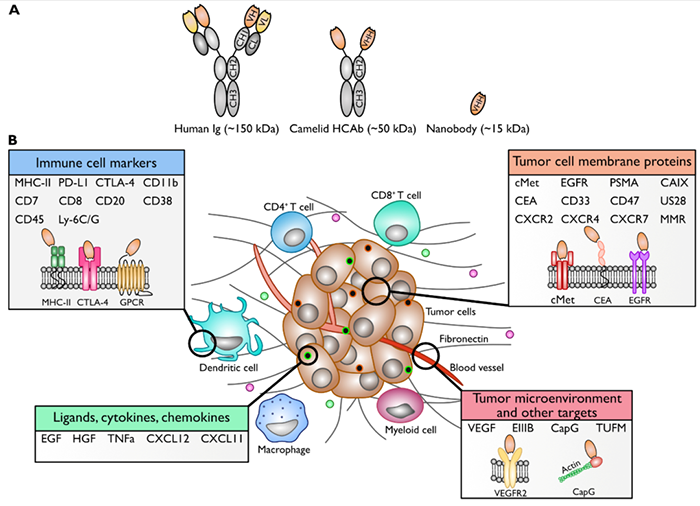
常见的肿瘤微环境纳米抗体开发靶点(文献3)
纳米抗体用于肿瘤影像诊断
PET,SPECT,超声等影像诊断是肿瘤诊断常用方法。
PET(positron emission tomography)
PET成像使用正电子发射放射示踪剂。正电子碰撞组织中电子,以光子的形式产生能量,可以用PET扫描仪检测。同位素标记的抗体或者抗体片段,被用于体内标记药物靶点,具有良好的特异性。纳米抗体因为分子量小,具有更好的组织穿透性,已经被用于评估病人药物靶点分布,以及肿瘤微环境研究。
68/67Ga或89Zr标记的EGFR抗体7D12是第一个在PET中使用的纳米抗体,显示出良好的肿瘤背景差。2016年68Ga 标记的HER纳米抗体被用于乳腺癌HER2表达的评估(文献5),之后两个2期临床在开展:
NCT03331601 Evaluation of 68-GaNOTA-Anti-HER2 VHH1 Uptake in Brain Metastasis of Breast Carcinoma Patients
NCT03924466 Repeatability of 68-GaNOTA-Anti-HER2 VHH1 PET/CT in Breast Carcinoma Patients (VUBAR)
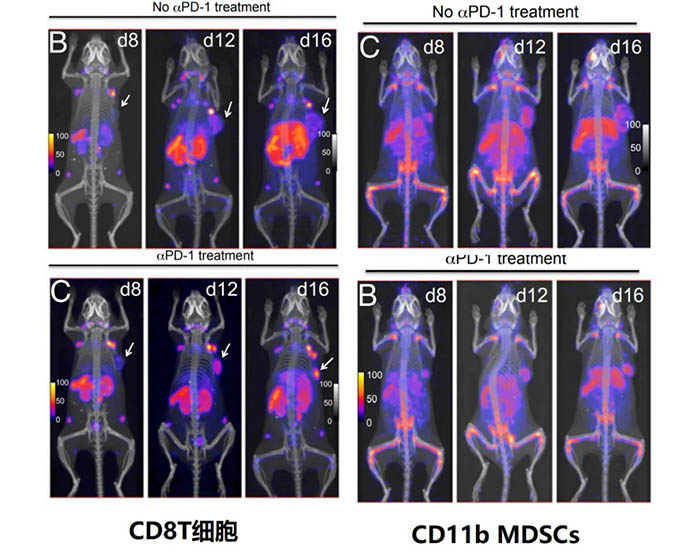
肿瘤微环境中的髓系抑制细胞(MDSCs)是重要的免疫治疗耐药因素之一。在小鼠模型,89Zr-labeled PEGylated anti-CD8和 anti-CD11b VHHs被用于 PET分析PD-1阻断治疗前后,CD8+T细胞和CD11b+ MDSCs细胞的分布(文献6)。
SPECT(Single photon emission computed tomography)
单光子发射计算机断层扫描(SPECT)成像应用伽马发射的放射性同位素,使用99mTc标记纳米抗体,可以在临床检测药物靶点的分布情况,作为用药指导。
2019年上海第一人民医院核医学科和伦敦国王学院在核医学杂志发表文章,使用99mTc标记的PD-L1单域抗体评估PD-L1在非小细胞肺癌患者体内表达,为免疫检查点抗体治疗提供基础。
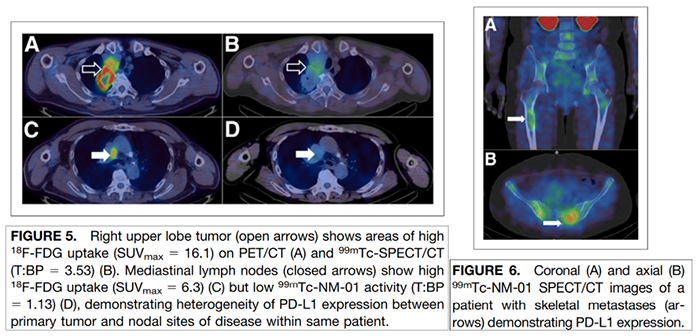
PD-L1在原发灶,淋巴结和骨转移灶的表达(文献7)
NIR荧光
PET和SPECT对于患者和病人都有放射线暴露,此外同位素的衰减速度,要求在注射后立刻进行影像检测,需要足够好的穿透性和合适的血液清除速率。所以非同位素的方法就有了开发的需求,红外荧光检测开始在动物模型使用,研究靶点表达,根据成像区域指导手术切除,肿瘤微环境研究等。
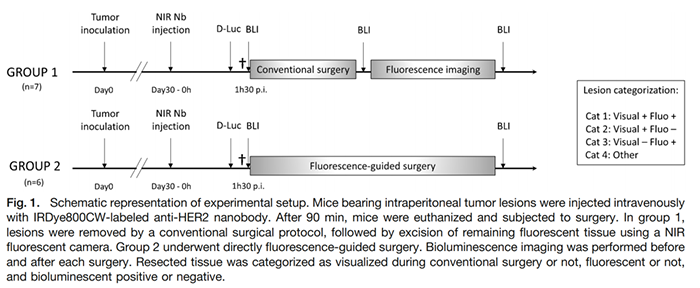
基于IRDye800CW标记HER2纳米抗体成像指导的手术切除(文献8)
基于超声的分子成像
超声是分子成像的重要分支,微珠和纳米珠可以作为超声造影剂。纳米珠可以使用聚合物及磷脂做壳,气体,液体,固体等做核,携带肿瘤特异性抗体,辅助诊断肿瘤。而完整的抗体分子量大,限制了达到靶部位的纳米珠的数量。
在小鼠模型,开始使用纳米抗体进行超声分子诊断。例如,使用携带anti-PMSA纳米抗体的纳米珠在异种移植小鼠模型,进行前列腺癌成像。但是在临床使用,还需要解决一些问题,如近端小管megalin受体,可以引起纳米抗体重吸收,引起肾潴留。如果携带有放射线或者毒性药物,则可以引起肾毒性。现在的策略是共同注射可以结合megalin受体的带正电的氨基酸,减少肾潴留。PEG化修饰也可以减轻肾潴留。
小编总结
近年纳米抗体引起了产业界的高度兴趣。Ablynx的caplacizumab是第一个获批的治疗性纳米抗体,国内康宁杰瑞,信达生物等都有纳米抗体的布局。但是除了作为治疗性抗体,小分子量的纳米抗体作为影像诊断抗体也有独特优势,比完整抗体分子更容易穿透到肿瘤核心,可以更完整检测靶点表达及分布。和经典的分子病理相比,纳米抗体分子影像能够更方便,更完整的评估原发灶,转移灶靶点表达水平,以及耐药分子表达水平,微环境抑制性免疫细胞数量等。基于纳米抗体开发影像诊断的伴随诊断试剂,可能是另外一个巨大的市场。
文章来源:生物制药
参考文献
1.A.S. Greenberg, D. A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks, Nature 374 (1995).
2.C. Hamers-Casterman, et al, Naturally occurring antibodies devoid of light chains, Nature 1 (363) (1993) 446–448.
3.Elisha R Verhaar et al,Nanobodies in cancer,Semin Immunol . 2020 Nov 30;101425.
4.M.J.W.D. Vosjan, et al, Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET, Eur. J. Nucl. Med. Mol. Imaging 38 (2011) 753–763
5.M. Keyaerts, et al, Phase I study of 68Ga-HER2-Nanobody for PET/CT assessment of HER2 expression in breast carcinoma, J. Nucl. Med. 57 (2016) 27–33,
6.M. Rashidian,et al, Immuno-PET identifies the myeloid compartment as a key contributor to the outcome of the antitumor response under PD-1 blockade, PNAS 116 (2019) 16971–16980,
7.Y. Xing, G. et al, Early phase I study of a 99mTc-labeled antiprogrammed death ligand-1 (PD-L1) single-domain antibody in SPECT/CT assessment of PD-L1 expression in non-small cell lung cancer, J. Nucl. Med. 60(2019) 1213–1220
8.P. Debie, M. Vanhoeij, et al, Improved debulking of peritoneal tumor implants by nearinfrared fluorescent nanobody image guidance in an experimental mouse model, Mol. Imaging Biol. 20 (2018) 361–367
9.X. Fan, L. Wang, Y. Guo, Z. Tu, L. Li, H. Tong, Y. Xu, R. Li, K. Fang, Ultrasonic nanobubbles carrying anti-PSMA nanobody: Construction and application in prostate cancer-targeted imaging, PLoS One 10 (2015) 1–13,














