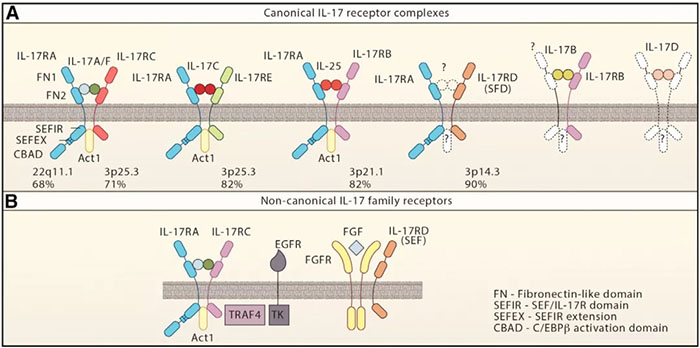
免疫治疗改变了癌症治疗的格局。之前预后不良的恶性肿瘤,对免疫检查点阻断产生显着反应,为晚期和转移性黑色素瘤,肾和肺癌等患者提供了希望。然而,也有一些肿瘤(如胰腺癌)对免疫治疗缺乏反应,原因是免疫抑制的肿瘤微环境。IL-17是肿瘤微环境中一种普遍存在的细胞因子,具有双重作用:即可以促进肿瘤生长;也可以诱导肿瘤消除。IL-17家族包含6个成员(IL-17A、B、C、D、E、F),5个受体(IL-17R A、B、C、D、E)。
IL-17及其受体(文献1)
不同亚型具有不同的起源细胞、组织特异性及功能,增加了IL-17与宿主免疫应答之间关系的复杂性。例如,IL-17A信号强度是IL-17F信号的10-30倍,这可能解释了为什么IL-17A参与了全身免疫功能,而IL-17F更多地参与了粘膜免疫。
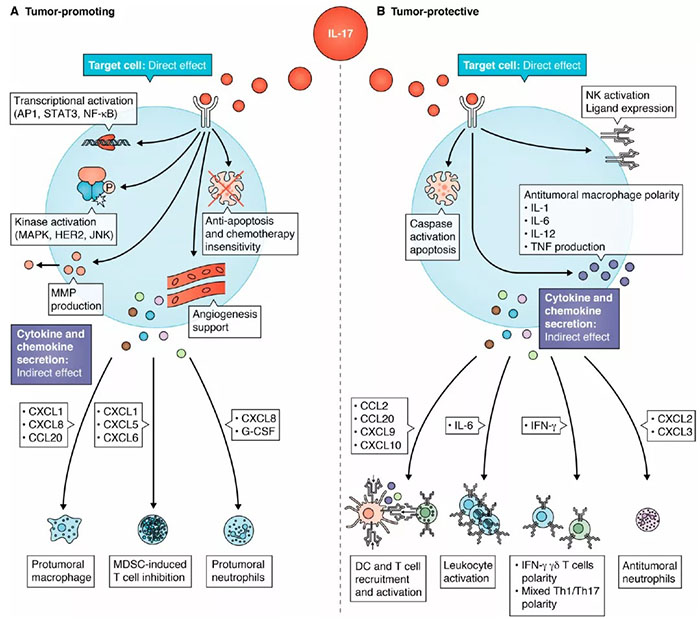
IL-17通过直接刺激癌细胞以及间接诱导免疫抑制性肿瘤环境而具有促肿瘤发展。IL-17在肿瘤细胞上结合IL-17R,下游激活一系列分子,包括转导转录因子(NF-κB、STAT和AP-1)、激酶(MAPK和HER1)、基质金属蛋白酶(MMPs)和抗凋亡蛋白(Akt、Erk、mTOR、Bcl-2和Bax)等。例如,IL-17连接通过NF-κB和MAPK途径以剂量依赖性的方式刺激卵巢癌干细胞的增殖和自我更新;通过MMP-2、MMP-7、MMP-9和NF-κB信号转导促进肝细胞癌侵袭和前列腺癌上皮间充质转化(EMT);IL-17通过IL-17R-Act1-TRAF4-MEKK3-ERK5回路直接促进角质形成细胞的增殖,促进MMP依赖的细胞侵袭,支持血管生成,抑制TGF-β依赖的细胞凋亡,增强MEK-、ERK-、JNK-和STAT3介导的乳腺癌细胞增殖,因此IL-17参与了许多肿瘤类型的肿瘤发生。IL-17介导的ERK激活和HER1磷酸化也促进了对紫杉醇化疗和酪氨酸激酶抑制的耐药性,表明IL-17不仅有促进癌细胞生长的作用,而且参与肿瘤耐药。胰腺癌细胞上的IL-17直接上调ERK信号,增加癌细胞的侵袭和内皮细胞的迁移,并支持癌细胞在远处器官的存活。在结直肠癌中,IL-17的分泌和膜结合形式都有助于细胞周期的进展和肿瘤的发生,IL-17的含量也与结肠腺瘤-癌序列发育不良直接相关。白细胞介素-17还通过趋化因子和细胞因子间接塑造抑制性免疫细胞微环境,支持癌细胞增殖。具体来说,IL-17诱导CXCL1、CXCL5、CXCL6和CXCL8的表达,从而增强髓源性抑制细胞在乳腺癌中的抑制功能,抑制淋巴瘤模型中T细胞浸润,在胰腺癌中招募肿瘤相关巨噬细胞,支持肺癌的血管生成和体内肿瘤生长。IL-17增强了乳腺癌体内全身G-CSF的表达,吸引了免疫抑制性中性粒细胞,最大限度地发挥了乳腺癌转移的潜力。总之,IL-17的直接和间接致癌特性相互补充,刺激早期肿瘤生长,抑制免疫系统。这些结果表明IL-17支持肿瘤生长、肿瘤进展、治疗耐药和转移,IL-17在肿瘤发生发展的早期作用更明显。
IL-17促肿瘤和抗肿瘤的双重作用(文献2)
抗肿瘤作用
IL-17的表达与多种癌症患者的预后和生存改善有关,支持IL-17在抗肿瘤免疫中的作用。非恶性乳腺上皮细胞分泌IL-17,与乳腺癌细胞上IL-17R结合,介导的caspase激活,诱导肿瘤细胞凋亡。IL-17还能激活免疫细胞,如上调CD107a、TNF、IFN-γ、穿孔素、NKp46、NKG2D和NKp44在NK细胞的表达,或通过IL-1、IL-6、IL-12和TNF的诱导巨噬细胞向抗肿瘤TAM极化。IL-17最有效抗肿瘤活性是间接作用,其指示先天和适应性免疫系统变得更具有细胞毒性。IL-17诱导食管鳞状细胞癌中CCL2、CCL20、CXCL9和CXCL10的产生,招募和激活T细胞、DC和NK细胞,与食管鳞状细胞癌患者总生存率的改善有关。IL-17还诱导肿瘤微环境中多种细胞产生IL-6,诱导白细胞的存活、增殖、募集和细胞毒性。IL-17的抗肿瘤作与IFN-γ在肿瘤微环境中的表达有关,Th1样IFN-γ产生的Th17细胞是抗肿瘤的主要介质。
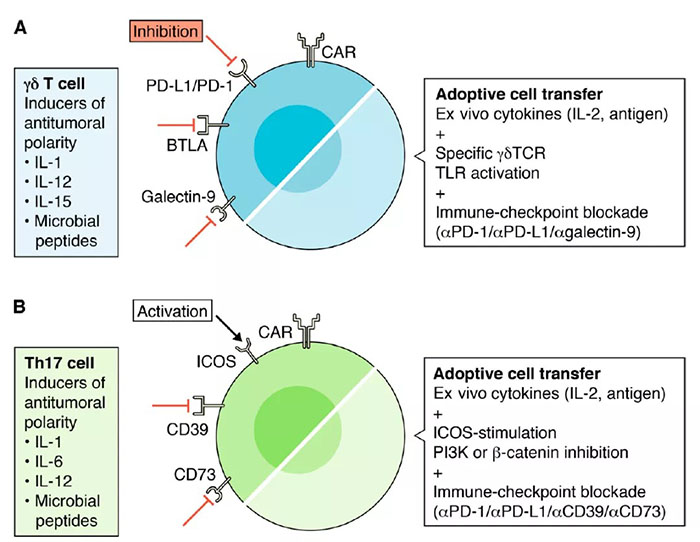
基于IL-17免疫治疗(文献2)
IL-17抗肿瘤活性主要由IFN-γ+IL-17+Th1/Th17细胞和IFN-γ+γδT细胞介导。
TCR刺激、细胞因子(IL-1、IL-6和IL-12)使Th17细胞获得Th1/Th17表型,并产生IFN-γ。胸腺IL-1、IL-12、IL-15、微生物肽连接特异性γδTCRs等,也可以刺激γδT细胞产生IFN-γ和IL-17。因而优化微环境中的细胞因子,诱导微环境中产生IL-17和IFN-γ的Th1/Th17和γδT,是肿瘤免疫治疗的重要方向。而B细胞和T淋巴细胞衰减因子(BTLA)负调控γδT细胞的细胞毒性和IL-17的产生,但BTLA拮抗的临床应用尚有待探索。TLR通过抗原特异性TCRs共刺激,直接增强γδT细胞的细胞毒性反应,临床应用也需要继续探索。与γδT细胞类似,Th17细胞表达低水平的PD-1、GRZB和穿孔素,高度表达共刺激标记ICOS和CD28,这成为ACT的一个重要考虑因素。Th17细胞具有自我更新、持久性强和抗凋亡能力,在体内介导和促进长期抗肿瘤免疫。ICOS刺激、PI3K抑制和β-catenin阻断是未来的Th17ACT治疗中值得考虑的因素。γδT细胞也同样正在被开发用于ACT免疫治疗。Vγ9Vδ2T细胞是人类血液中最丰富的γδT细胞,使用IL-2和zalendronate (模拟TLR结合)对γδT细胞进行极化,在前列腺癌、晚期肾细胞癌和神经母细胞瘤中显示出一定的疗效。γδTCRs不需要将抗原与MHC受体结合以产生免疫反应,从而使它们能够像天然免疫系统一样快速发挥作用。单克隆γδT细胞受体是抗原特异性的,但没有MHC限制性,因而不易发生移植排斥反应,有即用型细胞治疗产品开发潜力。IL-17展现出促肿瘤和抗肿瘤的两面性。已发表的数据支持这样的假设,即IL-17的促肿瘤活性,发生在炎症和癌症发生的早期,而抗肿瘤活性则与已建立的肿瘤细胞因子和免疫细胞微环境的变化相协调。免疫检查点阻断、共刺激受体的激活和γδT细胞和Th17的ACT应考虑这些细胞独特的个体发育、TCRs和免疫受体谱。进一步表征影响Th17和γδT细胞功能可塑性的免疫谱和因素,可能为基于IL-17的免疫治疗提供机会。
1.Mandy J McGeachy et al, The IL-17 Family of Cytokines in Health and Disease, Immunity . 2019 Apr 16;50(4):892-906.2.Gerardo A. Vitiello and George Miller, Targeting the interleukin-17 immune axis for cancer immunotherapy,J. Exp. Med. 2019,https://doi.org/10.1084/jem.201904563.Alessio Mazzoni et al,Biological and clinical significance of T helper 17 cell plasticity,Immunology. 2019 Dec;158(4):287-295
文章来源:生物制药