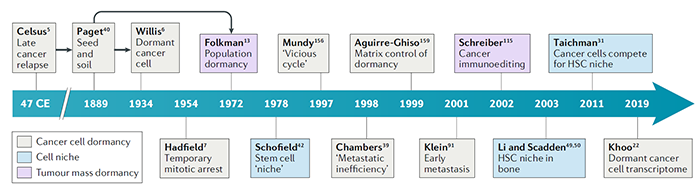
治疗和切除原发肿瘤后,有些患者很长时间后才出现转移,因而科学家想到了机体存在休眠的肿瘤细胞未被消灭。1934 年Rupert Willis提出了肿瘤细胞休眠的概念。1954年Geoffrey Hadfield认为这群细胞是进入了“暂时有丝分裂停滞”状态。这些休眠的肿瘤细胞如果随机被激活,则出现了晚期转移。其实最初的描述很清楚,但后续研究未坚持使用最初癌细胞休眠一词,不断引入了新的、重叠的概念,使得定义和认识发生了混淆。比如“药物耐受细胞”、“持久性细胞”、“肿瘤启动细胞”、“转移启动细胞”和“潜伏期能力细胞”,以描述具有产生肿瘤能力的单个细胞。例如,细胞增殖和死亡之间产生平衡,肿瘤量保持在一个较低且无法检测到的稳态水平,被称为“肿瘤量的休眠(Tumor mass dormancy)”。虽然这可能导致临床表现“休眠”,但它显然不同于休眠的癌细胞(休眠的肿瘤细胞细胞周期阻滞,不增殖)。
肿瘤干细胞是慢细胞周期细胞,并不是细胞周期阻滞,因而与休眠肿瘤细胞不同。其次,虽然一些干性标志物(SOX2,NANOG, NR2F1)在部分休眠肿瘤细胞表达,但是不是所有休眠细胞都表达。
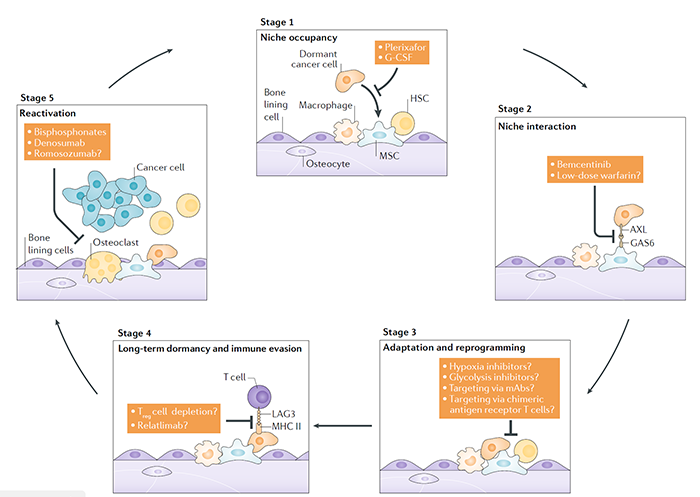
播散性癌细胞需要找到合适的支持niches,不同的肿瘤有不同的偏好,前列腺癌喜欢骨,腺腔型的乳腺癌也是如此;而三阴性乳腺癌(TNBCs)更喜欢内脏器官。对骨的偏好与乳腺癌中MAF癌基因表达的增强以及乳腺癌和前列腺癌细胞CXCR4的表达有关。CXCR4使它们能够回到分泌CXCL12和αvβ3整合素的骨髓壁龛中,使它们与含有Arg-Gly-Asp(RGD)基序的骨基质蛋白(维管素、纤维连接蛋白和骨桥蛋白等)结合。当然除了分子指引,还有多种机制参与。播散性癌细胞需要竞争和取代占据生态位的细胞才能定植吗?在静脉注射含有少量HSCs的中剂量同基因骨髓后,需要进行清髓以实现植入,这导致了一种观点,即有限数量的骨髓HSC壁龛都被占用。然而,最近的研究表明,当大量的HSCs被移植时,许多血管周围的壁龛仍然是空的,可以植入,这导致骨髓中HSCs的数量大量增加。相反,粒细胞-单核细胞祖细胞(GMPs)的数量保持不变,表明这种细胞类型的生态位被填充。plerixafor(CXCR4拮抗剂)开始进行临床研究(NCT00903968.,文献6),初步结果安全有效。
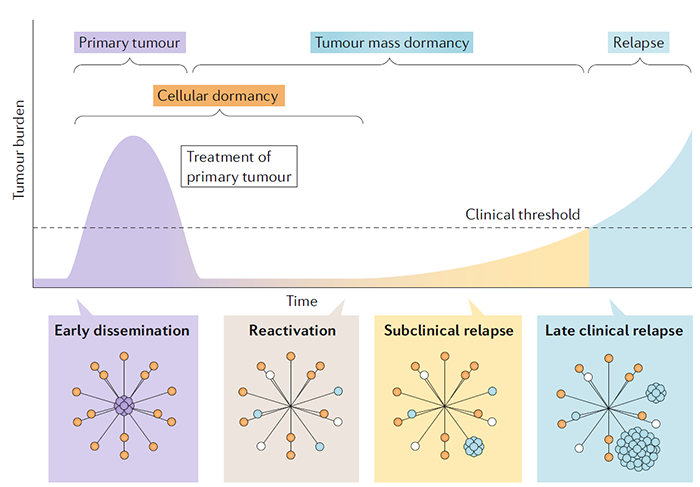
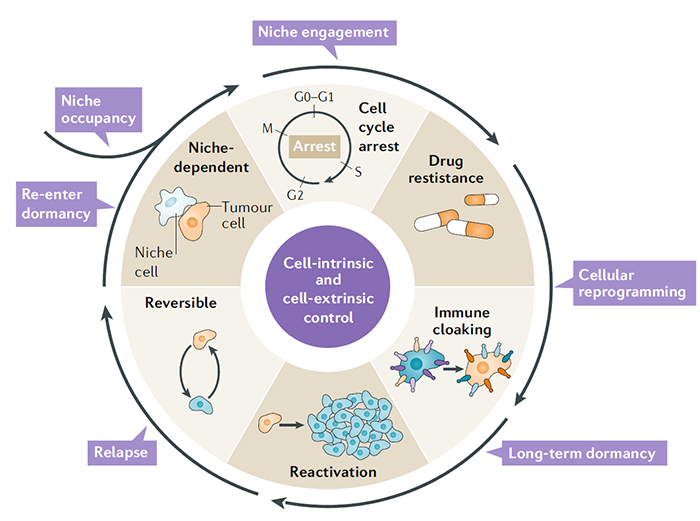
休眠的癌细胞与构成生态位的不同细胞之间,存在复杂的动态相互作用。环境中的物理因素,如氧气的可用性,可能在限制细胞增殖,并促进耐药性方面发挥作用。MDA-MB-231乳腺癌细胞在体外暴露于慢性间歇性缺氧,进入以G0-G1细胞周期阻滞为特征的休眠状态。在体内低氧条件下,暴露的肿瘤细胞打开休眠标记,并容易成为休眠。在多发性骨髓瘤、前列腺癌、乳腺癌中,越来越多的证据表明,在癌细胞与生态位细胞及其分泌分子的相互作用下,诱导休眠,导致化疗耐药。关于骨内生态位,来自原代成骨细胞的条件培养基和与MC3T3成骨细胞前体细胞共培养,降低5TGM1多发性骨髓瘤细胞增殖。以前已经证明,骨内壁龛中的细胞外骨桥蛋白诱导ALL细胞退出细胞周期并进入休眠。骨内生态位中的AnnexinA2也被证明通过上调GAS6(TAM家族受体酪氨酸激酶的配体),诱导休眠。GAS6可以由成骨细胞产生,并在体外阻止PC3人前列腺癌细胞的增殖。GAS6-Axl信号诱导的休眠是由前列腺癌细胞TGFβ和TGFβR的上调介导的。AXL inhibitor bemcentinib(BerGenBio ASA,BGB-324)多个癌种的临床试验在开展。
NCT03965494 AXL Inhibitor BGB324 in Treating Participants With Recurrent Glioblastoma Undergoing Surgery
NCT03649321 Chemotherapy With Nab-paclitaxel/Germcitabine/Cisplatin +/- BGB324 With Pancreatic Cancer
NCT02922777 Trial of Dose Escalated BGB324 in Previously Treated Non-small Cell Lung Cancer.
休眠的癌细胞是预先编程的,还是被niches重新编程为休眠?5TGM1多发性骨髓瘤细胞与成骨细胞前体细胞的共培养, 可以上调体内参与休眠的的几种基因。虽然有条件的培养基中的可溶性因子能够抑制体外的增殖,但却需要直接的细胞与细胞之间的接触来启动转录,重编程休眠的癌细胞。与休眠相关的基因主要是由转录因子IRF7和SPIC调控的基因,这表明干扰素信号在休眠的癌细胞生态位中发挥作用。休眠的癌细胞进行细胞重编程的过程,确保了它们适应生态位并逃避免疫监视。休眠的癌细胞与生态位的先天和适应性免疫细胞之间的复杂相互作用,可能在维持真正的细胞休眠中发挥作用。肿瘤细胞下调APC细胞的MHC1类分子表达,降低抗原递呈能力。表达免疫检查点,诱导T细胞耗竭等。通过这些机制,肿瘤细胞可以逃避免疫监视,能够长时间处于休眠状态。
激活和恢复效应细胞,清除抑制性性免疫细胞是这个阶段的主要治疗策略。
在适应营养不良的环境一段时间后,休眠的癌细胞积累了足够的营养物质来增殖和摆脱休眠。另外肿瘤免疫微环境改变,比如免疫衰老,化疗等引起的免疫损伤,免疫抑制剂的使用,免疫微环境异质性免疫细胞(MDSCs,Treg,TAMs,TANs等),TGF-β,IL-18等细胞因子表达。休眠肿瘤细胞所在的Niches重编程,也是激活的一个因素。与新血管形成相关的过程也重塑了细胞外环境。驻留在血管周围生态位中的休眠细胞通过血小板反应素1介导的内皮细胞相互作用来实现,新血管的萌发通过产生骨膜素和TGFβ1来刺激休眠细胞的重新激活和肿瘤的生长。
评论:生存也是肿瘤细胞的本能。肿瘤在局部形成一个适合自己生存的环境,通过休眠逃避免疫系统,对化疗产生耐受,创造存活的机会。
主要参考文献
Willis, R. A. The Spread of Tumours in the Human Body (J. & A. Churchill, 1934).
Hadfield, G. The dormant cancer cell. Br. Med. J. 2, 607–610 (1954).
Gimbrone, M. A. Jr., Leapman, S. B., Cotran, R. S.& Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261–276 (1972).
Pierce, G. B. & Speers, W. C. Tumors as caricatures of the process of tissue renewal: prospects for therapy by directing differentiation. Cancer Res. 48, 1996–2004 (1988).
Lapidot, T. et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature 367, 645–648 (1994).
Ghobrial, I. M. et al. Phase I/II trial of the CXCR4 inhibitor plerixafor in combination with bortezomib as a chemosensitization strategy in relapsed/refractory multiple myeloma. Am. J. Hematol. 94, 1244–1253 (2019).