对血液中游离DNA(circulating cell-free DNA, cfDNA)进行分析,从而在临床上用于肿瘤诊断、预后判断及用药指导等各方面的应用,已经展现出巨大的前景。但是由于血脑屏障的存在,对于脑部肿瘤患者,很少有报道在其血液中检测到特定的游离循环肿瘤DNA。

目前对于脑部肿瘤的检测主要分为:
具有创伤风险的颅内组织活检
低风险的核磁共振成像
脑脊液的细胞学检查
后两种方法都不能提供肿瘤组织基因组水平变化的信息
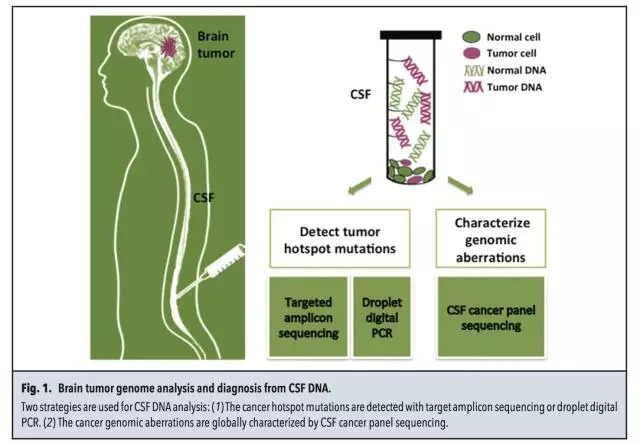
由于脑脊液(cerebral spinal fluid, CSF)在中枢神经系统内和病灶存在充分的接触,其中含有循环肿瘤细胞及循环肿瘤DNA。因此对脑脊液中的ctDNA检测也属于“液态活检”的范畴,可以对脑部肿瘤的原发灶及转移灶进行基因组水平的分析。
本期介绍斯坦福大学Stephen Quake教授实验室进行的工作,即通过ddPCR和NGS方法对脑脊液中的ctDNA进行分析。

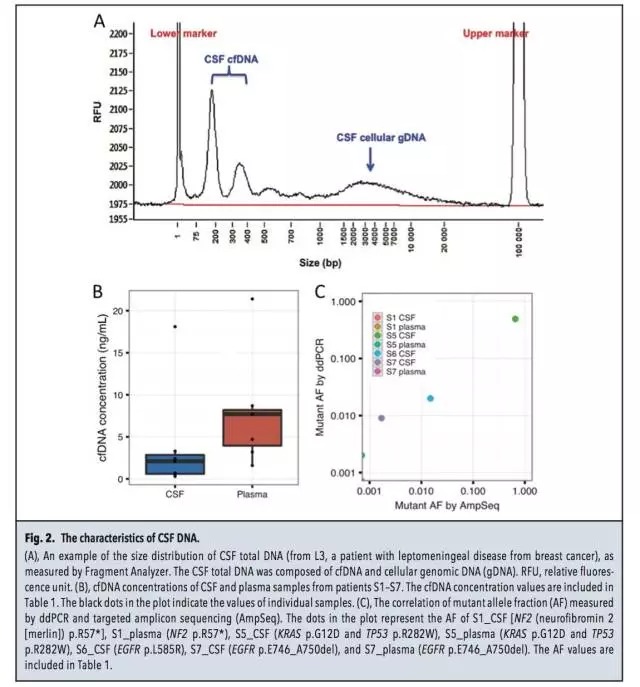
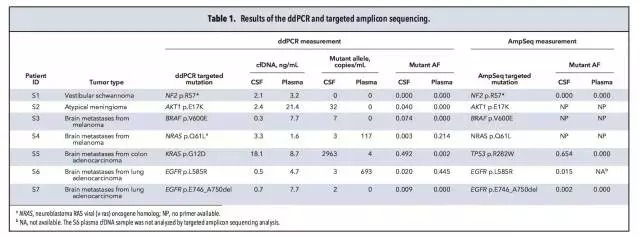
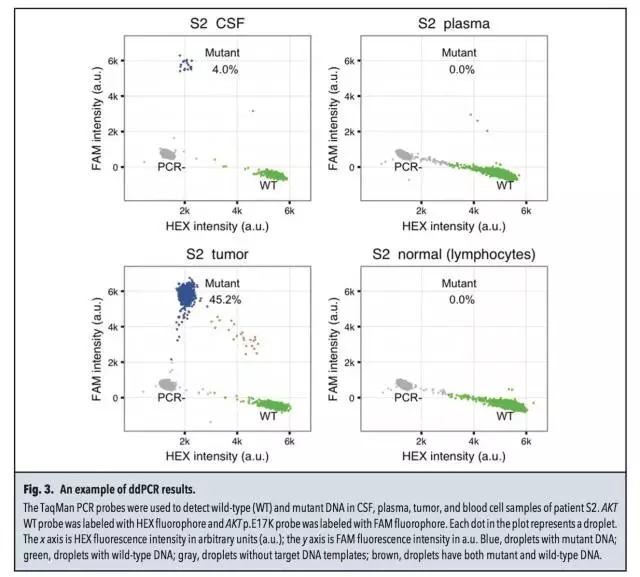
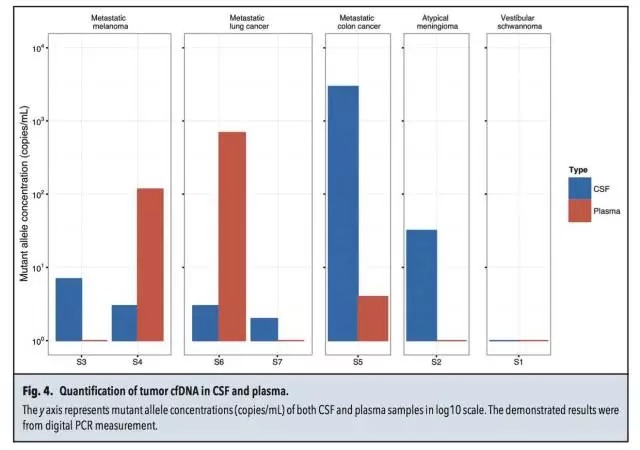
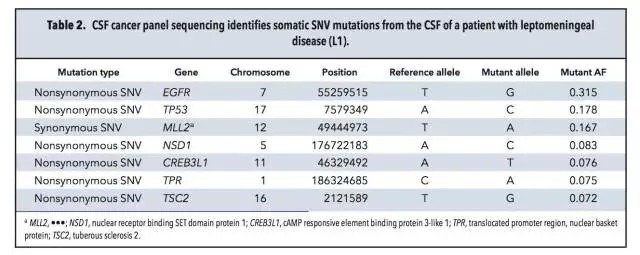
样品、检测平台 7名脑部实体瘤患者(S1-S7),均获得血液及脑脊液样品,同时通过手术获得病灶组织。 3名软脑膜病变患者(L1-L3),通过腰椎穿刺获得脑脊液样品。 微滴式数字PCR:QX100 droplet digital PCR。 NGS:HiSeq 2000和MiSeq。 总体实验流程 筛选肿瘤相关热点突变 对来源于正常组织和病灶组织的DNA进行外显子组测序,明确肿瘤相关的热点突变。本研究中,只有位于癌症相关基因外显子区域的非同义突变才被选为后续检测中的热点突变。 策略一:热点突变的检测 ddPCR和基于MiSeq的靶向测序。 策略二:Cancer Panel Sequencing 对一名软脑膜转移患者脑脊液的DNA进行测序。总体的实验流程见下图,又一次展示了NGS+dPCR的联合应用。 脑脊液中DNA的性质 1、两种来源DNA的长度分布 脑脊液中DNA来源于两种:cfDNA和细胞来源的gDNA。下图A中160bp和340bp位置对应的DNA为cfDNA,更大片段的DNA为细胞来源,主要来自CSF中的白细胞和肿瘤细胞。 2、cfDNA的浓度 与血液中cfDNA的浓度相比,脑脊液中的cfDNA浓度更低。ddPCR检测结果显示:S1-S7患者脑脊液中的cfDNA平均浓度为2.1 ng/mL,血液中对应的cfDNA浓度为7.7 ng/mL。浓度范围:0.3~18.1 ng/mL。具体结果见下图B所示。 脑脊液中肿瘤热点突变的检测 根据正常组织和病灶组织的DNA进行外显子组测序、比对的结果,共选出了7个肿瘤相关的热点突变,分别采用ddPCR及NGS进行分析。 1、针对具体突变位点丰度的检测,ddPCR和NGS靶向测序结果具有一致性,具体结果见上图C及下表所示。 2、在7名实体瘤患者的CSF中,仅患者S1的脑脊液中没有检测到对应的NF2 p.R57突变,其余6名患者全部实现检出。 脑脊液和血液中热点突变丰度的比较 对7名实体瘤患者(S1-S7)的脑脊液和血液样品中的热点突变进行检测,并比较两种样品中的突变丰度,突变丰度的比较以ddPCR检测结果为准。 1、在S2、S3和S7患者的血液中,均没有检测到突变位点,但在CSF中均测得突变位点的存在,丰度分别为4%,7.4%和0.9%。(S2为原发性脑部肿瘤,S3和S7分别为恶性黑色素瘤和肺腺癌在脑部的转移灶) 2、在S5患者(结肠癌在脑部的转移灶)的脑脊液和血液中均测得突变,CSF中的突变丰度高于血液。 3、在S4和S6患者的血液和脑脊液中均测得突变位点,血液中的突变丰度高于脑脊液。造成这种现象可能的原因是S4和S6两名患者的转移灶不仅限于中枢神经系统,S4的转移灶还涉及骨骼肌、腹腔和肺部;S6的转移灶还涉及肝脏。 4、对S2原发性脑癌患者的脑脊液、血液、病灶组织及淋巴细胞的AKT p.E17K检测显示:病灶中的丰度最高,为45.2%;脑脊液中能实现检出,丰度为4%;血液中不能实现检出;作为对照的淋巴细胞中不存在AKT p.E17K突变。具体结果见下图。 5、对7名患者血液及脑脊液中突变的丰度比较见下图,结果证实了之前的假设:对于还未发生全身性病灶转移的脑部肿瘤患者,相比于传统的血液检测,在脑脊液中更易测得相关突变。 脑脊液的Cancer Panel Sequencing 上述结果证实,对于脑部肿瘤,通过对脑脊液中DNA的分析是一种有应用前景的无创诊断手段,可作为组织活检的辅助手段。接下去,本研究对一名肺腺癌的软脑膜转移患者(L1)的脑脊液DNA进行Cancer Panel Sequencing,试图了解该患者的突变谱。考虑到测序成本,该panel sequencing针对已知癌症基因的编码区域,测序的平均coverage为300X。 1、测序结果共测得7个SNP突变位点,其中2个分别为EGFR和TP53。 2、在KRAS密码子12/13并没有发现突变,测序结果与肺腺癌原发灶病理样品的毛细管电泳测序结果一致。Cancer Panel Sequencing结果见下表。 陈斯卡的读后感 1、NGS和dPCR的关系 NGS技术的应用,最近几年的发展完全可以用“狂飙突进”来形容。2000年就采用Sanger测序完成了“黄地老虎颗粒体病毒”全基因组测序的主力成员陈斯卡,一方面深知NGS的强大(2000年左右,测序的平均coverage超过10X的话就很“高大上”了),另一方面总觉得NGS和dPCR的联用是比较合理的workflow。 本文出自斯坦福大学Stephen Quake的实验室,他是生物工程与应用物理学领域的著名科学家,也是Flulidigm、Verinata Health和Helicos BioSciences的创办人,本身就是位“测序达人”。在研究中采用的两种策略就体现了NGS和dPCR的联用,策略一的前提是突变位点明确,追求检测的灵敏度及成本控制;策略二更适合于对基因谱进行全面的分析。 2、NGS和dPCR联用背后的原因 越来越多的研究中出现了NGS和dPCR联合使用的workflow,这是现象,背后的原因是什么?陈斯卡尝试给出一个解释。 NGS和dPCR本质上都是一种数字化的核酸计数技术,用英语表述可能更贴切:digital DNA/RNA counting technology,这是两者可以联用的基础。但两者计数的维度和进制不同:dPCR的计数在扩增子(amplicon)水平,采用二进制(0或者1);NGS的计数在单碱基(nucleotide)水平,采用四进制(如果不考虑碱基的各种修饰),这是需要两者联用达到互补的原因。 3、NGS将来能否取代dPCR? 可以!条件是测序技术足够好,足够方便和便宜。 现在学术界存在两种意见:一种认为NGS已经强大到可以做任何事情,另一种觉得NGS虽然强大,但根据研究的目的及对数据的要求,对NGS数据进行验证是必要的。就目前的NGS技术来看,陈斯卡支持后一种看法。爱因斯坦说:If you can‘t explain it simply, you don‘t understand it well enough。以这个标准衡量,目前的NGS已经很好,但还不够好。 4、“液态活检”和“血液检测”的关系 2015年是“液态活检”大热的一年,但是在很多场合下都将“血液检测”概念等同于“液态活检”。虽然临床上血液是最常规的样品之一,但“液态活检”的概念范畴应该大于“血液检测”。从本研究的结果可以看出,对于脑部肿瘤,脑脊液的检测就优于血液。 目前,除了血液和脑脊液,其他液态形式的样品还有:痰液、尿液、胆汁、胸腹水等等,并且这些液态样品都已被用于数字PCR的检测。如果真的想通了“液态活检”的核心概念,其实粪便样品的检测也属于“液态活检”。