细胞信号通路详解:TGF-β通路
2020-11-07
分类:
生物研究
阅读(6549)
收藏
体内组织中的细胞增殖,胚胎发生、分化和细胞死亡过程中细胞的特定命运都受到多种细胞与细胞之间信号的控制,这种控制一旦发生异常,将会带来非常严重的后果。这些调控信号中最突出的是TGF-Beta超家族,该家族包含大量不同的多肽形态发生因子,包括TGF-Beta本身以及BMP(骨形态发生蛋白)和GDF(增长和分化因子)(参考文献1)。TGF-Beta家族的成员会在不同的时间点并以组织特异性的形式表达,因此在机体中大多数组织的发育、稳态平衡和修复中起重要作用。所有免疫细胞,包括B细胞、T细胞和树突状细胞,以及巨噬细胞,都分泌TGF-Beta,而TGF-Beta又通过其他细胞因子负调控免疫细胞的增殖、分化和激活。因此,TGF-Beta是一种有效的免疫抑制剂,TGF-β信号的紊乱还与自身免疫、炎症和癌症有关(参考文献2)。
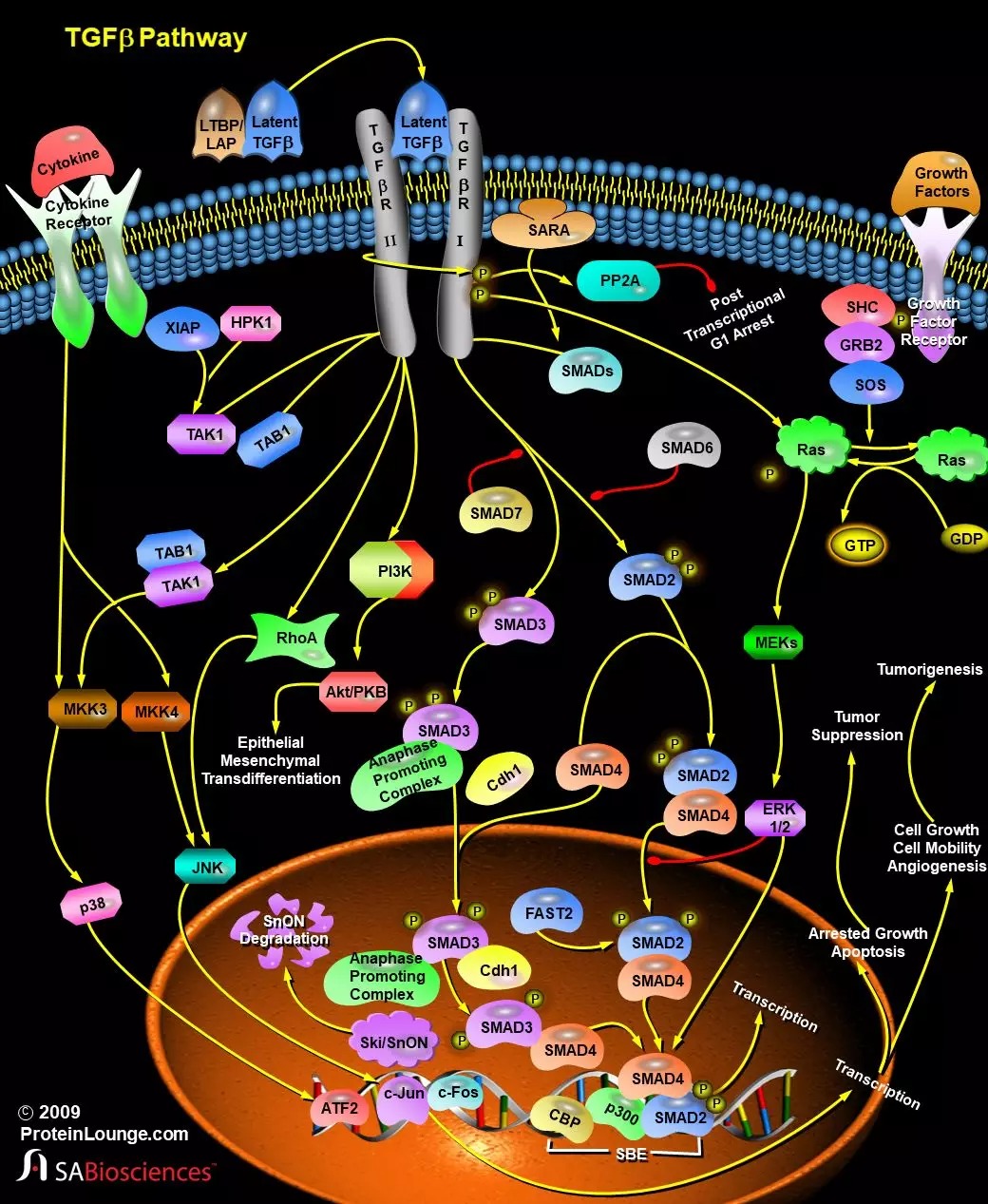 在与受体结合之前,TGF-β首先会被一个大的复合物激活,该复合物由LTBP和LAP (Latency Associated Peptide) 组成。在与II型受体(TGF-BetaRII)结合后,会将I型受体(TGF-BetaRI)募集到高度保守的近膜区域(也称为GS域)。然后,激活的TGF-BetaRI会磷酸化其下游靶标,包括信号转导子SMAD(Sma和Mad相关家族)家族成员SMAD2和SMAD3(参考文献3)。它们与SMAD4形成异源寡聚复合物并转运至细胞核,然后在启动子处与DNA序列特异性结合位点ATF2 (Activating TranscriptionFactor-2) 和SBE (SMAD Binding Element) 上的其他转录因子相互作用,从而调控基因表达。SMAD异源复合物还可以与p300和CBP(CREB结合蛋白)等转录共激活因子和共抑制因子相互作用,由此将SMAD-TF复合物与基础转录机制联系起来,并介导TGF-β的生物学作用(参考文献3)。SMAD2-SMAD4复合物通过与DNA结合蛋白,例如FAST2 (Forkhead Activin Signal Transducer-2),特异性的相互作用来调控转录反应。这些激活的靶基因有些会刺激肿瘤发生,而另一些则抑制肿瘤发生。之后SMAD2会被泛素化,并被蛋白酶体系统降解(参考文献5)。过表达SMAD7会激活TGF-BetaRI,从而抑制SMAD2和SMAD3的磷酸化。SMAD6在结构上与其他SMAD蛋白差异较大,并且可以与TGF-BetaRI稳定结合。SMAD6会干扰SMAD2的磷酸化,并且随后与SMAD4形成异聚体,但是其并不抑制SMAD3的活性。受体–SMAD相互作用的特异性是由SMAD受体激酶域的离散结构元件和SMAD中的MAD同源域决定的。在激活之前,受体调节的SMAD通过诸如SARA(SMAD受体激活锚)的因子锚定在细胞膜上,从而使SMAD接近TGF受体激酶(参考文献4)。TGF-β还可以诱导其他非SMAD信号传导途径,包括通过上游介导子RhoA、Ras激活几种MKKs (MAP kinase Kinase) 和MEKs (MAPK/ERK Kinase) 途径(JNK/SPAK,p38和ERK1/2)。TAK1 (TGF-Beta Activated Kinase)、TAB1 (TAK1 Binding Protein) 和蛋白XIAP (Xenopus Inhibitor of Apoptosis),HPK1 (Haematopoietic Progenitor Kinase-1) 也会参与其中(参考文献2)。由于其在细胞命运决定中的关键作用,TGF-β信号转导受到多个层次的正和负调节,包括靶向受体和细胞内介体的调控。在SMAD功能的负调节子中,原癌蛋白Ski家族的两个高度保守的成员,c-Ski和c-SnON,可以通过与SMAD2/SMAD3和SMAD4的直接相互作用来拮抗调节TGF-β信号传导(参考文献6),之后便被降解并释放SMADs以调节转录。SMAD3会将APC (Anaphase-Promoting Complex) 和Cdh1 (Cadherin-1) 募集到SnON,从而为靶向SnON的泛素化和降解提供了另一种机制(参考文献3)。除了直接诱导或抑制靶基因表达外,TGF-βα还诱导多种复杂的细胞反应,具体取决于细胞类型,其中最显著的是涉及PI3K (Phosphatidylinositol-3-Kinase) 和PP2A (Protein Phosphatase-2A) 的G1晚期的生长停滞、分化程序的变化和凋亡(参考文献3)。其他生长因子也可以通过Ras的GRB2 (Growth Factor Receptor-Bound Protein-2)-SOS激活来调节TGF-β介导的信号传导。
在与受体结合之前,TGF-β首先会被一个大的复合物激活,该复合物由LTBP和LAP (Latency Associated Peptide) 组成。在与II型受体(TGF-BetaRII)结合后,会将I型受体(TGF-BetaRI)募集到高度保守的近膜区域(也称为GS域)。然后,激活的TGF-BetaRI会磷酸化其下游靶标,包括信号转导子SMAD(Sma和Mad相关家族)家族成员SMAD2和SMAD3(参考文献3)。它们与SMAD4形成异源寡聚复合物并转运至细胞核,然后在启动子处与DNA序列特异性结合位点ATF2 (Activating TranscriptionFactor-2) 和SBE (SMAD Binding Element) 上的其他转录因子相互作用,从而调控基因表达。SMAD异源复合物还可以与p300和CBP(CREB结合蛋白)等转录共激活因子和共抑制因子相互作用,由此将SMAD-TF复合物与基础转录机制联系起来,并介导TGF-β的生物学作用(参考文献3)。SMAD2-SMAD4复合物通过与DNA结合蛋白,例如FAST2 (Forkhead Activin Signal Transducer-2),特异性的相互作用来调控转录反应。这些激活的靶基因有些会刺激肿瘤发生,而另一些则抑制肿瘤发生。之后SMAD2会被泛素化,并被蛋白酶体系统降解(参考文献5)。过表达SMAD7会激活TGF-BetaRI,从而抑制SMAD2和SMAD3的磷酸化。SMAD6在结构上与其他SMAD蛋白差异较大,并且可以与TGF-BetaRI稳定结合。SMAD6会干扰SMAD2的磷酸化,并且随后与SMAD4形成异聚体,但是其并不抑制SMAD3的活性。受体–SMAD相互作用的特异性是由SMAD受体激酶域的离散结构元件和SMAD中的MAD同源域决定的。在激活之前,受体调节的SMAD通过诸如SARA(SMAD受体激活锚)的因子锚定在细胞膜上,从而使SMAD接近TGF受体激酶(参考文献4)。TGF-β还可以诱导其他非SMAD信号传导途径,包括通过上游介导子RhoA、Ras激活几种MKKs (MAP kinase Kinase) 和MEKs (MAPK/ERK Kinase) 途径(JNK/SPAK,p38和ERK1/2)。TAK1 (TGF-Beta Activated Kinase)、TAB1 (TAK1 Binding Protein) 和蛋白XIAP (Xenopus Inhibitor of Apoptosis),HPK1 (Haematopoietic Progenitor Kinase-1) 也会参与其中(参考文献2)。由于其在细胞命运决定中的关键作用,TGF-β信号转导受到多个层次的正和负调节,包括靶向受体和细胞内介体的调控。在SMAD功能的负调节子中,原癌蛋白Ski家族的两个高度保守的成员,c-Ski和c-SnON,可以通过与SMAD2/SMAD3和SMAD4的直接相互作用来拮抗调节TGF-β信号传导(参考文献6),之后便被降解并释放SMADs以调节转录。SMAD3会将APC (Anaphase-Promoting Complex) 和Cdh1 (Cadherin-1) 募集到SnON,从而为靶向SnON的泛素化和降解提供了另一种机制(参考文献3)。除了直接诱导或抑制靶基因表达外,TGF-βα还诱导多种复杂的细胞反应,具体取决于细胞类型,其中最显著的是涉及PI3K (Phosphatidylinositol-3-Kinase) 和PP2A (Protein Phosphatase-2A) 的G1晚期的生长停滞、分化程序的变化和凋亡(参考文献3)。其他生长因子也可以通过Ras的GRB2 (Growth Factor Receptor-Bound Protein-2)-SOS激活来调节TGF-β介导的信号传导。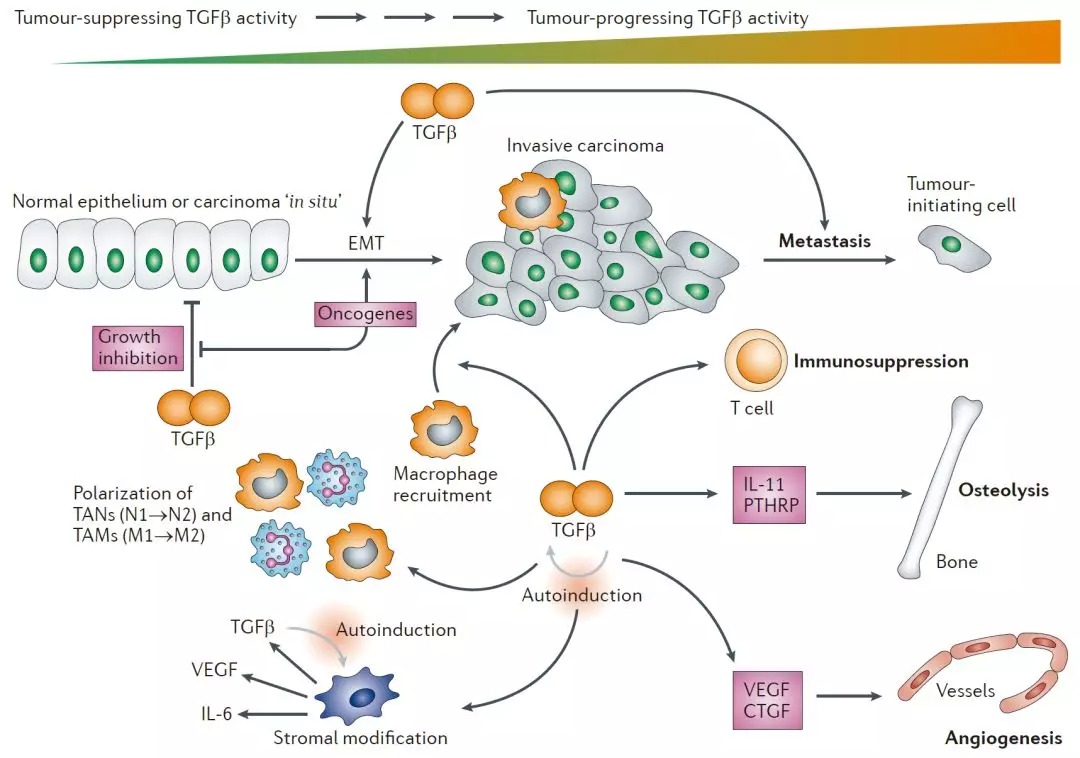 TGF-β可能是最多效性的分泌蛋白,其作为形态发生子,介导包括血液生成、激素分泌的调控、免疫应答、血管生成、组织形态发生和再生以及骨诱导和调节在内的几种生理过程。关于骨诱导,TGF-β诱导肌肉组织部位大量软骨内骨形成,但缺抑制骨部位中骨形成(参考文献1)。TGF-β信号传导的失调与多种疾病的发展有关,例如血液系统恶性肿瘤,例如白血病、血液性毛细血管扩张、软骨发育不良、伤口愈合不良、神经退行性疾病、发育障碍和肺动脉高压等。TGF-β信号传导的遗传性或表观遗传性丢失,会通过抑制免疫系统和上皮肿瘤细胞的细胞分化变化来促进肿瘤发生,这种现象称为EMT (Epithelial Mesenchymal Transdifferentiation)(参考文献2)。另外,也有研究将TGF-β与瘤抑制的其他过程联系起来,包括维持基因组稳定性、诱导衰老、抑制端粒酶活性和防止不适当的血管生成。最近,在某些感染了HIV1的患者中,TGF-β水平的升高促进了病毒的产生,损害了宿主的免疫系统,这表明TGF-β可能在HIV1病毒基因的调控和发病机制中发挥了作用(参考文献7)。1. Ripamonti U, Crooks J, Matsaba T, TaskerJ. Induction of endochondral bone formation by recombinant humantransforming growth factor-beta2 in the baboon (Papio ursinus). GrowthFactors. 2000; 17(4): 269-85. PubMed ID: 108010762. Moustakas A, Pardali K, Gaal A, HeldinCH. Mechanisms of TGF-beta signaling in regulation of cell growth anddifferentiation. Immunol Lett. 2002 Jun 3; 82(1-2): 85-91. PubMed ID: 120080393. Roberts AB, Derynck R. Meetingreport: signaling schemes for TGF-beta. Sci STKE. 2001 Dec 18; 2001(113):PE43. PubMed ID: 117526314. Imai Y, Kurokawa M, Izutsu K, HangaishiA, Maki K, Ogawa S, Chiba S, Mitani K, Hirai H. Mutations of the SMAD4 genein acute myelogeneous leukemia and their functional implications inleukemogenesis. Oncogene. 2001 Jan 4; 20(1): 88-96. PubMed ID: 112445075. Huo YY, Zhang KT, Li BY, Duan RF, FanBX, Xiang XQ, Hu YC, Xie L, Wu DC. Regulation of SMAD7 gene by TGF-beta 1 inprocess of malignant transformation. Ai Zheng 2002 Feb; 21(2): 117-21 PubMedID: 124790576. Wu JW, Krawitz AR, Chai J, Li W, ZhangF, Luo K, Shi Y. Structural mechanism of SMAD4 recognition by the nuclearoncoprotein Ski: insights on Ski-mediated repression of TGF-beta signaling.Cell. 2002 Nov 1; 111(3): 357-67. PubMed ID: 124192467. Li JM, Shen X, Hu PP, Wang XF. Transforminggrowth factor beta stimulates the human immunodeficiency virus 1 enhancer andrequires NF-kappaB activity. Mol. Cell Biol. 1998 Jan; 18(1): 110-21. PubMedID: 9418859
TGF-β可能是最多效性的分泌蛋白,其作为形态发生子,介导包括血液生成、激素分泌的调控、免疫应答、血管生成、组织形态发生和再生以及骨诱导和调节在内的几种生理过程。关于骨诱导,TGF-β诱导肌肉组织部位大量软骨内骨形成,但缺抑制骨部位中骨形成(参考文献1)。TGF-β信号传导的失调与多种疾病的发展有关,例如血液系统恶性肿瘤,例如白血病、血液性毛细血管扩张、软骨发育不良、伤口愈合不良、神经退行性疾病、发育障碍和肺动脉高压等。TGF-β信号传导的遗传性或表观遗传性丢失,会通过抑制免疫系统和上皮肿瘤细胞的细胞分化变化来促进肿瘤发生,这种现象称为EMT (Epithelial Mesenchymal Transdifferentiation)(参考文献2)。另外,也有研究将TGF-β与瘤抑制的其他过程联系起来,包括维持基因组稳定性、诱导衰老、抑制端粒酶活性和防止不适当的血管生成。最近,在某些感染了HIV1的患者中,TGF-β水平的升高促进了病毒的产生,损害了宿主的免疫系统,这表明TGF-β可能在HIV1病毒基因的调控和发病机制中发挥了作用(参考文献7)。1. Ripamonti U, Crooks J, Matsaba T, TaskerJ. Induction of endochondral bone formation by recombinant humantransforming growth factor-beta2 in the baboon (Papio ursinus). GrowthFactors. 2000; 17(4): 269-85. PubMed ID: 108010762. Moustakas A, Pardali K, Gaal A, HeldinCH. Mechanisms of TGF-beta signaling in regulation of cell growth anddifferentiation. Immunol Lett. 2002 Jun 3; 82(1-2): 85-91. PubMed ID: 120080393. Roberts AB, Derynck R. Meetingreport: signaling schemes for TGF-beta. Sci STKE. 2001 Dec 18; 2001(113):PE43. PubMed ID: 117526314. Imai Y, Kurokawa M, Izutsu K, HangaishiA, Maki K, Ogawa S, Chiba S, Mitani K, Hirai H. Mutations of the SMAD4 genein acute myelogeneous leukemia and their functional implications inleukemogenesis. Oncogene. 2001 Jan 4; 20(1): 88-96. PubMed ID: 112445075. Huo YY, Zhang KT, Li BY, Duan RF, FanBX, Xiang XQ, Hu YC, Xie L, Wu DC. Regulation of SMAD7 gene by TGF-beta 1 inprocess of malignant transformation. Ai Zheng 2002 Feb; 21(2): 117-21 PubMedID: 124790576. Wu JW, Krawitz AR, Chai J, Li W, ZhangF, Luo K, Shi Y. Structural mechanism of SMAD4 recognition by the nuclearoncoprotein Ski: insights on Ski-mediated repression of TGF-beta signaling.Cell. 2002 Nov 1; 111(3): 357-67. PubMed ID: 124192467. Li JM, Shen X, Hu PP, Wang XF. Transforminggrowth factor beta stimulates the human immunodeficiency virus 1 enhancer andrequires NF-kappaB activity. Mol. Cell Biol. 1998 Jan; 18(1): 110-21. PubMedID: 9418859



