动物细胞中,对氧气的感知和反应是一个非常重要的过程,在包括癌症、心血管疾病和中风在内的多种疾病的病理生理学中占有重要地位。该过程主要由HIF(缺氧诱导因子)及其调节子pVHL (VonHippel-Lindau tumor suppressor protein)调控。HIF1是具有螺旋-环-螺旋结构(helix-loop-helix)的转录因子,可激活那些编码参与低氧稳态反应蛋白质的基因。它还可以诱导控制葡萄糖代谢、细胞增殖和血管形成的蛋白质表达。缺氧直接或间接调节了参与细胞分化的几种基因。包括Epo(促红细胞生成素)、LDHA(乳酸脱氢酶-A)、ET1(内皮素-1)、transferrin(转铁蛋白)、transferrin receptor(转铁蛋白受体)、VEGF(血管内皮生长因子)、Flk1、FLT1(Fms相关酪氨酸激酶1)、PDGF-Beta(血小板衍生生长因子-β)、bFGF(碱性成纤维细胞生长因子)和其他影响糖酵解的基因(参考文献1)。
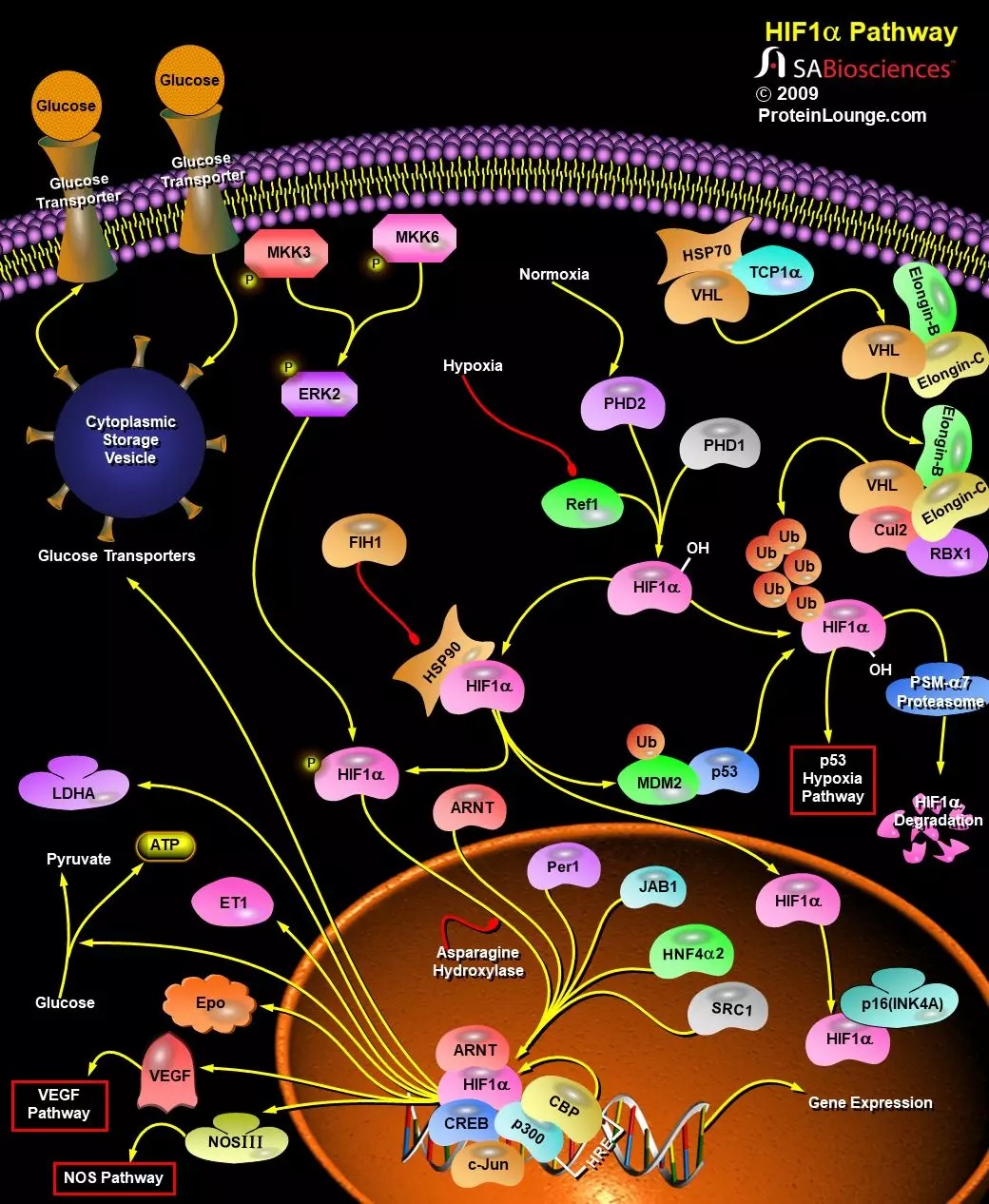
HIF1是由两个基本的螺旋-环-螺旋PAS(Per-ARNT-Sim)蛋白-HIF1-Alpha和HIF1-Beta组成的异二聚体。HIF1-Alpha在缺氧条件下会累积表达,而HIF1-Beta则是组成型表达。HIF1-Alpha是肿瘤细胞低氧反应的重要媒介,并控制许多对实体瘤扩张非常重要的因子(包括血管生成因子VEGF)的上调。HIF1-Beta是一种芳烃受体核转运子(ARNT,Aryl hydrocarbon Receptor Nuclear Translocator),是异源生物应答的重要组成部分(参考文献2)。
在氧气存在的情况下,HIF会被一个包含pVHL的E3泛素连接酶降解。当HIF来源的肽段核心区域的保守脯氨酸残基被羟基化时,就会与人pVHL结合。人类基因组包含EGL9 (Egg Laying Nine-9)同源物,分别称为EGLN1、EGLN2和EGLN3,也分别被称为PHD2、PHD1和PHD3 (Prolyl Hydroxylase Domain-Containing Proteins)。脯氨酰羟化酶可以对HIF1-α进行翻译后修饰,从而使其与VHL复合物相互作用。脯氨酰羟化酶中有一个含铁结构,因此铁螯合剂可以抑制其活性。脯氨酰羟化酶的所有三种蛋白都可以在ODD中两个脯氨酸位点之一(Pro-402和Pro-564)上羟化HIF1-Alpha。HIF2-Alpha和HIF3-Alpha中也存在类似的脯氨酰残基。
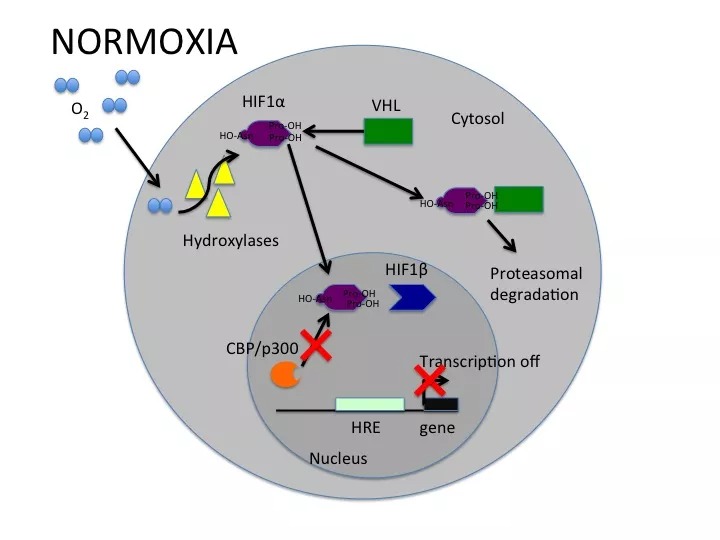
在有氧的情况下,EGLN蛋白会被激活,并能使HIF1-Alpha的ODD结构域羟基化,从而使pVHL结合并多聚泛素化HIF(参考文献3)。VHL是一种较大复合物的一部分,该复合物包括Elongin-B、Elongin-C、Cul2、RBX1 (Ring-Box 1)和泛素结合酶(E2)。该复合物与泛素激活酶(E1)一起介导HIF1-Alpha的泛素化(Ub)。HIF1-Alpha被Ub修饰后会被降解,这个过程可以被蛋白酶体抑制剂阻止。
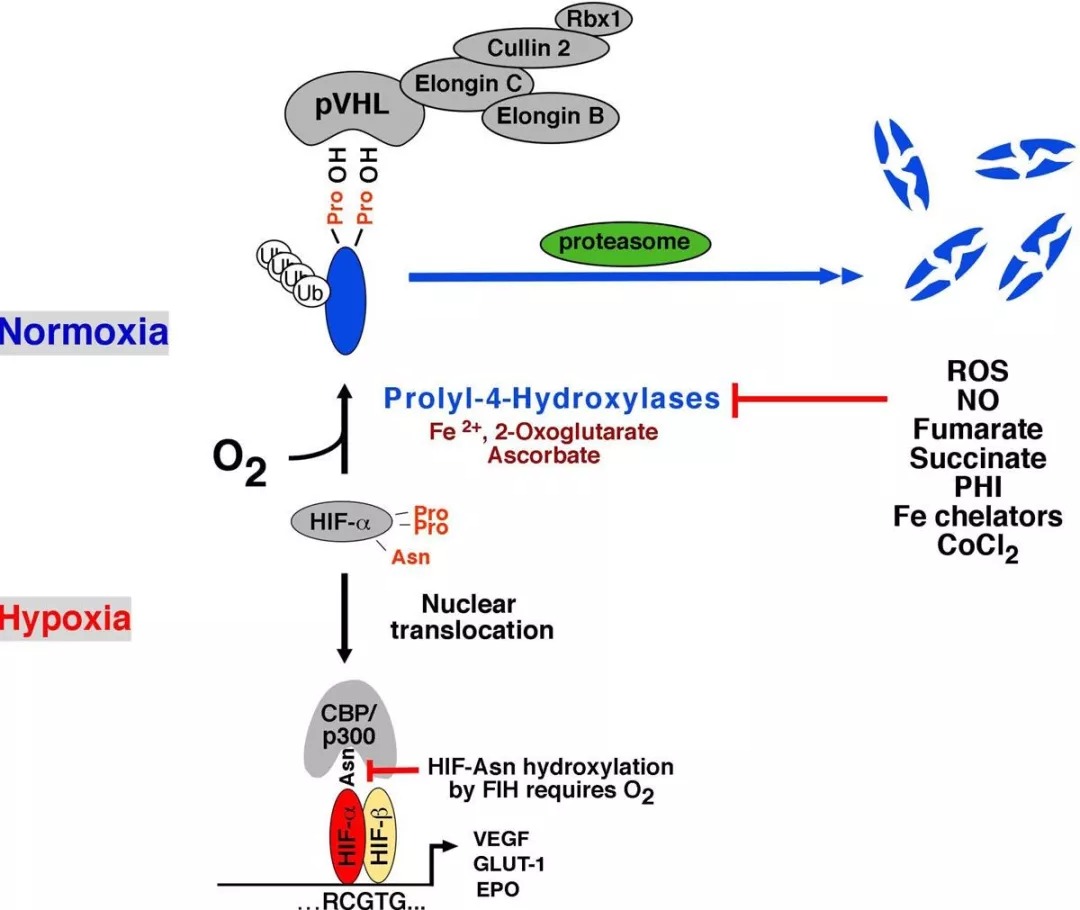
在缺氧条件下,HIF1-Alpha亚基无法被pVHL识别,因此它们会得以积累并与HIF1-Beta形成二聚体,随后转移到细胞核内,在核内它们与辅因子CBP/p300和Pol II复合物等相互作用,并与HRE(缺氧反应元件)结合,由此激活靶基因的转录。HIF1-Alpha激活的基因包括:VEGF-促进血管生成;GLUT1(葡萄糖转运蛋白-1)-激活葡萄糖转运;LDHA(乳酸脱氢酶)-参与糖酵解途径;和Epo-诱导红细胞生成。HIF1-Alpha还可以激活NOS(一氧化氮合成酶)的转录,从而促进血管生成和血管舒张。研究表明,其他的一些蛋白,如ARNT2和MOP3(Pas超家族3的成员)也是可以与HIF1-Alpha形成异源二聚体的(参考文献4)。
HIF1-Alpha也可以被ERK2调节,ERK2可以磷酸化HIF1-Alpha。HIF1-Alpha还与分子伴侣HSP90(Heat Shock Protein-90)相关。HSP90拮抗剂还可以抑制HIF1-Alpha的转录活性,并显著降低低氧诱导的VEGF mRNA的积累和低氧依赖性的血管生成活性。近来,有研究发现了抑制HIF1-α活化的因子FIH (Factor Inhibiting HIF1-Alpha),其可能代表了HIF进一步的调控机制。
缺氧还会诱导p53蛋白的积累。在缺氧条件下,p53可以与HIF1-Alpha直接相互作用,并通过促进MDM2介导的泛素化和蛋白酶体降解来抑制缺氧诱导的HIF1-Alpha表达。此外,在缺氧条件下,HIF1-Alpha可以通过与JAB1(Jun激活结构域结合蛋白-1)和ODD结构域的直接相互作用,从而阻止了与p53的相互作用,进而阻断了p53介导的降解。HIF1-Alpha还可以与HNF4alpha2 (Hepatocyte Nuclear Factor-4-Alpha 2)相结合,后者可与HIF1-Alpha一起响应缺氧条件从而激活Epo基因。
缺氧与人类诸多重大疾病的病理生理都有关联,包括心肌和脑缺血、癌症、肺动脉高压、先天性心脏病和慢性阻塞性肺疾病等(参考文献5)。
参考文献:














