介导细胞与细胞之间信号转导的信号通路,对于发育、细胞分化和体内稳态至关重要。这些通路的失调也通常与人类恶性肿瘤相关。JAK(Janus tyrosine Kinase)-STAT(Signal Transducer and Activator ofTranscription)信号通路在进化上具有很多保守的功能,包括细胞增殖和血液生成。
JAK属于非受体蛋白酪氨酸激酶家族,大约130kDa,由JAK1、JAK2、JAK3和TYK2(non-receptor Protein Tyrosine Kinase-2)组成。STATs是潜在的细胞质转录因子,在被募集到激活的受体复合物后会被激活。已经鉴定出了七个STAT蛋白,STAT1-6,包括STAT5a和STAT5b(由不同的基因编码)。
另外,已经鉴定出了几种STAT的异构体。其在从粘液霉菌到人类的真核生物中进化上有很好的保守性,JAK-STAT信号似乎是早期的适应手段,以此促进了细胞间通讯,这种通讯与无数细胞信号事件共同进化。这种共同进化又引起了高度适应的、控制基因表达的配体特异性信号传导途径的发展。此外,JAK-STAT信号传导途径受到大量内在和环境刺激的调节,这可以增加细胞或组织反应的可塑性(参考文献1和2)。
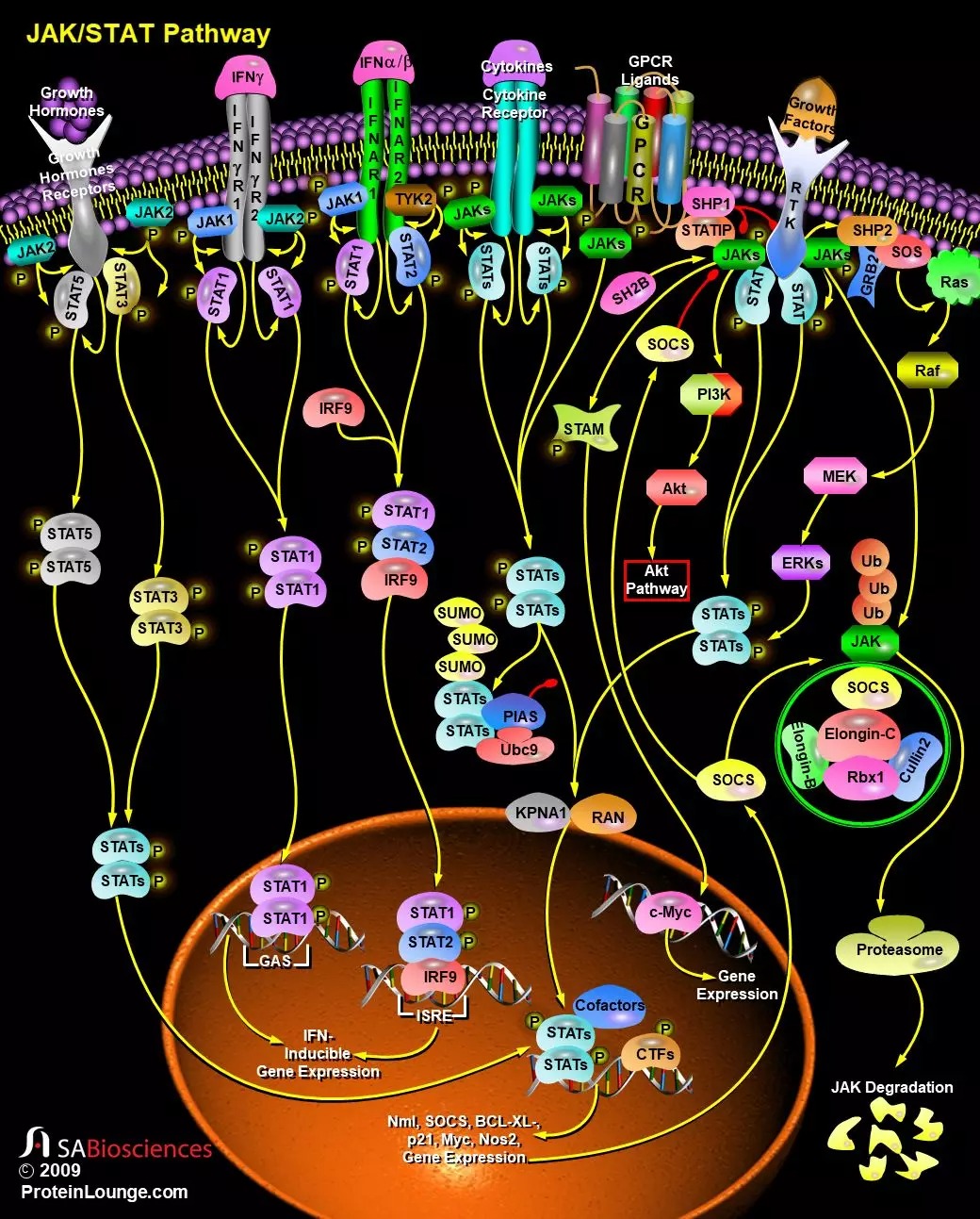
从机理上讲,JAK/STAT信号通路相对简单,只有几个主要组成成员。包括细胞因子、激素和生长因子在内的各种配体及其受体可以激活JAK/STAT通路。
当配体结合时可以诱导受体亚基的多聚化,由此诱发细胞内激活。对于某些配体,例如Epo(促红细胞生成素)和GH(生长激素),受体亚基以同二聚体形式结合,而对于其他配体,例如IFNs(干扰素)和ILs(白介素),受体亚基是异多聚体。信号传导时,两个受体亚基的胞质部分必须与JAK酪氨酸激酶相结合。配体结合后引起受体分子的多聚化,使得与受体偶联的JAKs相互接近并通过交互的酪氨酸磷酸化而活化。随后,活化的JAK磷酸化其他靶标,包括受体和主要底物STATs。七个哺乳动物STATs在C端有一个保守的酪氨酸残基,该残基可以被JAK磷酸化。该磷酸化的酪氨酸可以让STATs通过保守的SH2结构域相互作用,从而使STATs二聚化。
不同的JAK和STAT被不同的配体激活。例如,诸如GH、Epo和Tpo(血栓生成素)类激素通常会刺激JAK2以及STAT3和5的激活。磷酸化的STATs通过依赖于ImportinAlpha-5(也称为nucleoprotein interactor 1)的机制以及Ran入核通路进入细胞核。一旦进入细胞核,二聚化的STATs就会结合到特定的调控序列,从而激活或抑制靶基因的转录。因此,JAK/STAT级联通路提供了将细胞外信号转化为转录反应的直接机制。RTK(受体酪氨酸激酶)通常激活Ras/Raf/MEK/ERK信号通路,但过度激活时也可以诱导JAK/STAT通路。JAK/STAT通路最初是作为细胞因子受体下游的信号级联通路被发现的(参考文献3和4)。
细胞因子及其受体是JAK/STAT通路的主要激活因子。Ifns是抗病毒细胞因子,许多细胞类型都可以在感染病毒后产生这种因子。
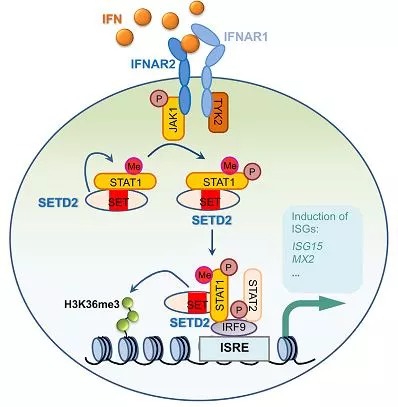
Ifns分为I型和II型。I型Ifns包括Ifn-α,-β,-Omega和-Tau,它们都是单体。唯一的II型Ifn是Ifn-γ,它是二聚体。I型和II型Ifns与不同的受体结合,可以激活重叠但截然不同的基因的表达。Ifn是JAK/STAT通路的重要调节子。Ifn-α/β由两个亚基IfnAR1和IfnAR2组成,它们在受到Ifn刺激后形成异二聚体。这会导致两个JAK激酶的激活:JAK1和TYK2,随后将STAT1和STAT2蛋白磷酸化。磷酸化的STATs从受体异二聚体上解离,并与IRF(Interferon Regulatory Factor-9)家族成员IRF9/p48结合,形成主要干扰素基因因子的三聚体,称为ISGF3(Interferon-Stimulated Transcription Factor-3)复合物。该复合物转运至细胞核,并与顺式元件ISRE(Ifn-stimulated Response Element)结合,从而启动了多个Ifn诱导型基因的转录。Ifn-γ与其受体结合会导致JAK1和JAK2酪氨酸激酶的酪氨酸磷酸化,从而导致STAT1而不是STAT2磷酸化。磷酸化的STAT1均二聚形成GAF-AAF复合物,该复合物转运至细胞核并与大多数Ifn-γ诱导型基因中存在的GAS元件结合(参考文献5和6)。
除了该途径的主要成员外,还鉴定到了一些其他的效应蛋白,这些效应蛋白至少参与了部分JAK/STAT信号转导事件。STAM(signal-transducing adapter molecules)是具有保守VHS和SH3结构域的衔接分子。STAM1和STAM2A可以被JAK1-JAK3磷酸化,其方式主要依赖于某些STAMs中存在的第三个域-ITAM(inducibletyrosine-based activation motif)。通过一个尚未研究清楚的机制,STAM促进特定靶基因(包括Myc)的转录激活。促进JAK/STAT途径活化的第二个衔接子是STATIP(STAT-Interacting Protein),这是一种WD40蛋白。STATIPs可以与JAK和未磷酸化的STATs结合,可能是作为支架蛋白以此促进STATs被JAKs磷酸化。在JAK/STAT信号通路起功能的第三类衔接子是SH2B/Lnk/APS系列。这些蛋白质既包含pleckstrin同源序列又包含SH2结构域,并且还是JAK磷酸化的底物。SH2-Bβ和APS都与JAK有关,但前者促进JAK/STAT信号传导,而后者则抑制它(参考文献1和7)。
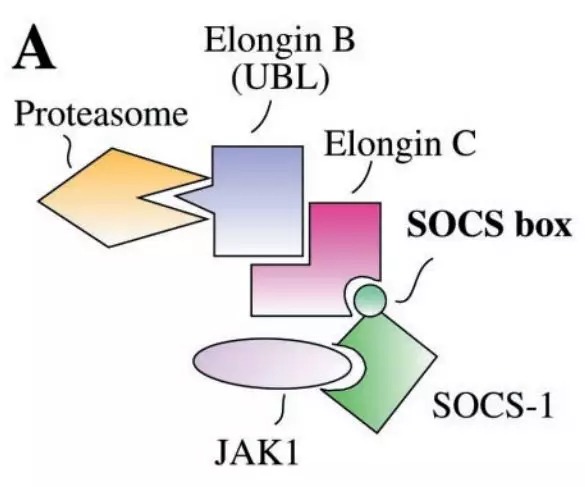
JAK/STAT途径除了效应子外,还有三大类负调节子:SOCS(suppressors of cytokine signaling),PIAS(protein inhibitors of activated STATs)和PTPs(protein tyrosine phosphatases)。最简单的也许是酪氨酸磷酸酶,它可以逆转JAK的活性。而其中最有特色的是SHP-1。SHP-1包含两个SH2结构域,可以与磷酸化的JAK或磷酸化受体向相结合,从而促进这些活化信号分子的去磷酸化。其他酪氨酸磷酸酶,例如CD45,似乎也可以通过一部分受体调节JAK/STAT信号通路。第二类负调节子是SOCS。SOCS蛋白是一个至少包含八个成员的家族,这个家族的成员在C端包含一个SH2结构域和一个SOCS盒。SOCS家族的标志就是SOCS盒,该结构介导与Elongin-B/C复合物的相互作用,并将SOCS和相关的靶蛋白JAKs偶联至蛋白降解途径。SOCS盒的NH2末端包含一个保守的Elongin-B/C结合基序(BC Box)并且与Elongin-C结合,后者又与由Elongin-B、Cullin家族成员和RING指蛋白Rbx-1形成一个多蛋白复合物,由此充当E3泛素连接酶。E3泛素连接酶与ATP依赖性泛素激活酶(E1)和泛素结合酶(E2)一起,将近端蛋白质标记一个泛素链。泛素化的蛋白将会被蛋白酶体途径降解。泛素通过dUB(deubiquitinating enzymes)再循环,然后该循环得以继续进行。SOCS在JAK/STAT通路中完成了一个简单的负反馈回路:激活的STATs刺激SOCS基因的转录,而翻译的SOCS蛋白与磷酸化的JAK及其受体结合,从而关闭该途径。第三类负调节子是PIAS蛋白:PIAS1、PIAS3、PIASx和PIASy。PIAS蛋白与活化的STAT二聚体结合并阻止其与DNA结合。具体的PIAS蛋白作用机制尚不清楚。不过,已有研究表明PIAS蛋白可以与E2接合酶Ubc9结合,由此具有了E3接合酶的活性,并通过RING指结构域进行SUMO化修饰。尽管有证据表明STATs可以被SUMO化修饰,但这种修饰在负调控中的功能尚不清楚(参考文献8、9和10)。
尽管JAK/STAT信号传导机制相对简单,但因其与其他信号传导途径的相互作用使该途径活化后的生物学后果变得非常复杂。JAK/STAT信号通路还通过SOCS3的转录激活间接促进Ras信号传导。SOCS3可以结合RasGAP(Ras信号的负调节子),并降低其活性,从而促进Ras途径的激活。相反,RTK途径可以通过至少两种机制促进JAK/STAT信号传导。首先,某些RTK(包括EGFR和PDGFR)的激活可能导致STATs的JAK非依赖性的酪氨酸磷酸化,这可能是Src激酶引起的。其次,RTK/Ras途径的刺激引起下游MAPK的激活。MAPK可以特异性磷酸化大多数STATs C端附近的丝氨酸。另外,还可以通过与受其他信号通路调控的转录因子(c-Jun、IRF9、c-Fos、NF-KappaB、SMAD、SP1)和辅因子(例如p300、CBP、BRCA1、MCM5)相结合而改变激活的STATs的功能。除了激活STAT外,JAK激酶还可以磷酸化其他信号/转接蛋白,从而使得JAK与其他途径(例如MAP激酶)也联系起来。JAK或STAT也可以通过其他类别受体参与信号传导。STATs还参与许多疾病,如乳腺癌(肿瘤)、头颈癌(细胞系)、多发性骨髓瘤、赤霉素白血病、急性粒细胞性白血病、EBV相关的伯基特氏淋巴瘤和疱疹病毒依赖沙门氏菌的淋巴瘤(参考文献11&12)。














