AHR(Aryl Hydrocarbon Receptor)是转录调节子bHLH(basic Helix-Loop-Helix)-PAS(Per-ARNT-Sim)家族的一员,该家族主要调控各种发育和生理功能,包括神经发生、气管和唾液管形成、毒素代谢、昼夜节律、对缺氧的反应和激素受体功能等。bHLH-PAS家族成员的独特特征是具有PAS域,此域的名称来源于最先发现具有这个基序的三个蛋白:Drosophila Per,Human ARNT和Drosophila Sim。PAS结构域由260-310个氨基酸组成,包括两个非常保守的疏水重复序列,称为PAS-A和PAS-B,由一个保守性比较差的序列所间隔。总之,PAS结构域保守性并不好,并且可以介导许多不同的生化功能。
AHR,也称为二恶英受体,是暴露于PAH(多环芳烃)、二恶英(例如TCDD)和多氯联苯后大多数毒性反应的罪魁祸首。AHR的配体有多种,包括食用的化合物、天然以及合成的黄酮类化合物、天然产物和药物等。AHR可以通过与各种调控和信号蛋白相互作用来影响细胞信号传导,包括PAS异二聚体伴侣ARNT(芳烃受体核转运蛋白)、伴侣和免疫样蛋白(例如HSP90(Heat Shock Protein-90)、AIP(芳烃受体-相互作用蛋白)、p23、蛋白激酶以及磷酸激酶(例如酪氨酸激酶、CK2(酪蛋白激酶-2)、PKC(蛋白激酶-C))和共激活因子(例如SRC1(类固醇受体共激活因子-1),RIP140,CBP/p300)。另外,AHR还与ESR(雌激素受体)以及其他激素受体、低氧、NF-KappaB和Rb蛋白介导的信号通路有相互作用(参考资料1和2)。
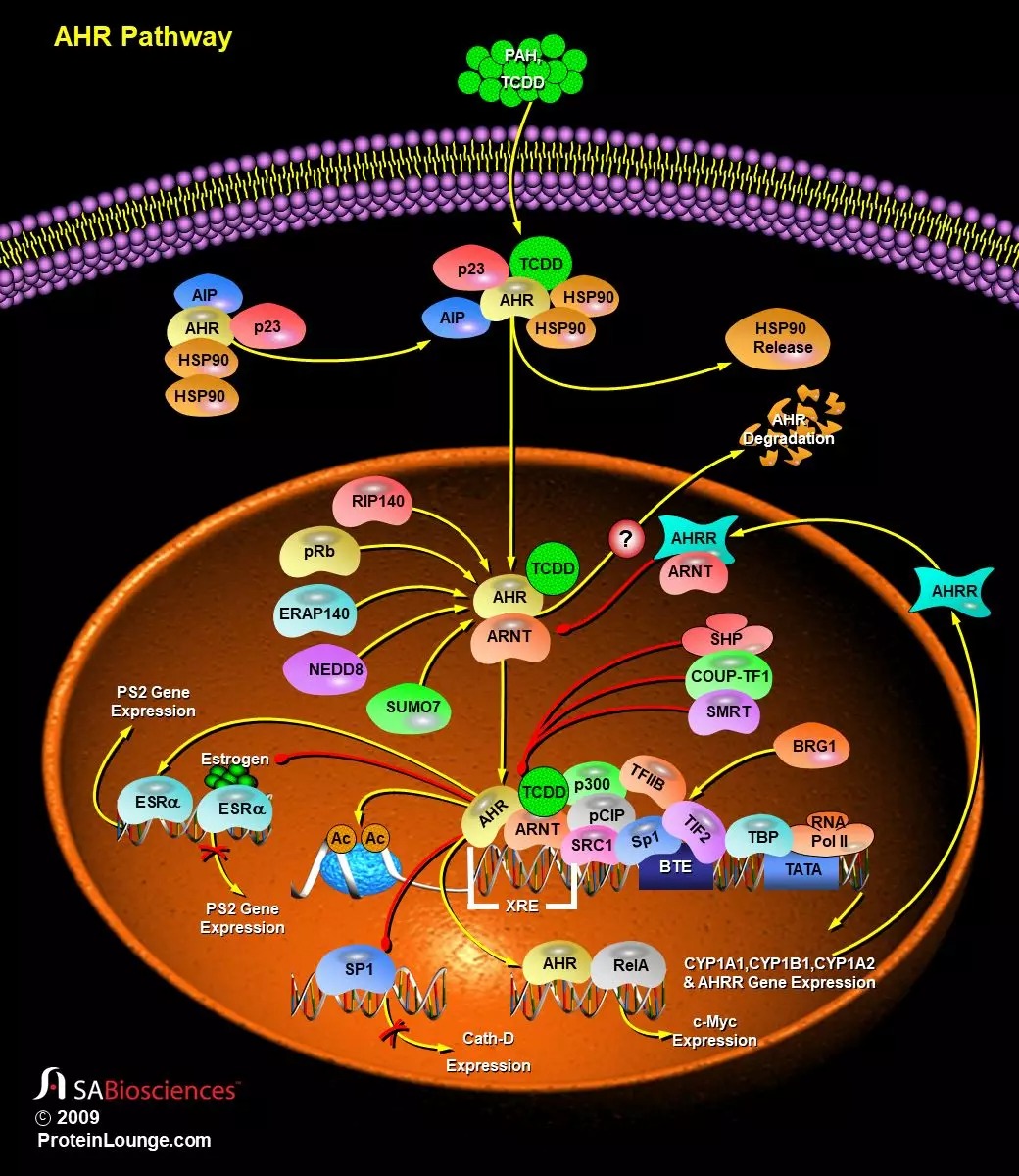
通常情况下,AHR会在胞浆内与HSP90、XAP2(X-AssociatedProtein-2,也被称为ARA9和AIP)和HSP90的伴侣蛋白p23形成一个复合物处于休眠状态。当其结合相应的配体后,这个复合物中的AHR会被激活,并且发生构象的改变,从而暴露出一个和定位信号序列(NLS)。其中HSP90会从复合物中被释放出来,而AHR受体则被转运至核内,与ARNT形成异二聚体。这个异二聚体会与XRE(异源生物响应元件)结合,并改变增强子XRE控制的基因的表达。XREs具有保守的核心序列“GCGTG”,存在于异种生物代谢的几个基因的启动子区域,包括CYP1A1 (Cytochrome P450 Family-1 Subfamily-APolypeptide-1),CYP1A2(Cytochrome P450 Family-1 Subfamily-APolypeptide-2),CYP1B1(Cytochrome P450 Family-1Subfamily-B Polypeptide-1)和NAD(P)H-奎宁氧化还原酶。CYP1A1基因的表达除了通过TATA序列、XRE和BTE(basic transcriptionelement,a GC box)外,还可以通过至少两种调控DNA元件以底物诱导的方式进行调控。XRE上的反式作用因子是AHR/ARNT异二聚体,而SP1充当BTE的调节子。SP1与BTE的结合通过物理相互作用促进了AHR/ARNT异二聚体与XRE的结合,反之亦然,从而共同增强了CYP1A1基因的表达。
AHR/ARNT异二聚体与XRE序列结合,然后募集CBP或p300到ARNT的C端激活域(参考资料3和4)。其他几个核受体共激活因子也可以与AHR相互作用,包括ERAP140、RIP140、BRG1(Brahma-Related Gene-1)、Rb、PML(Acute Promyelocytic Leukemia Inducer),NEDD8(Neural precursor cell Expressed, Developmentally Down-regulated-8)、SUMO1(Small UbiquitinRelated Modifier-1)和p160家族共激活子的三个成员:NCOA1(Nuclear Receptor Coactivator-1)/SRC1、NCOA2(Nuclear Receptor Coactivator-2)/GRIP1/TIF2和NCOA3(Nuclear ReceptorCoactivator-3)/AIB1/pCIP/ACTR。
AHR和共激活因子的有序和周期性结合导致了组蛋白的乙酰化、Pol II(RNA Polymerase-II)的募集和基因的转录。在某些情况下,AHR的激活也会抑制基因的转录,例如编码免疫球蛋白重链和雌激素诱导的p27、组织蛋白酶D和pS2(Gastrointestinal Trefoil Protein-pS2)的基因(参考资料5、6和7)。
一种称为AHRR(AHR阻遏物)的新型PAS蛋白通过竞争性结合ARNT或者与XRE结合来抑制AHR信号转导。AHRR由AHR诱导,由此形成了一个负反馈回路,用于调节AHR。PKC和酪氨酸激酶也参与了AHR信号转导,这些激酶的抑制剂同样阻止了靶基因的诱导表达。AHR的其他负调节子包括SMRT(Silencing Mediator for Retinoic acid andThyroid hormone receptor)、COUP-TFI(Chicken Ovalbumin Upstream Promoter-Transcription Factor-1)和SHP(Small Heterodimer Partner)。SMRT与AHR结合并抑制CYP1A1反式激活,而SHP则抑制AHR/ARNT-DNA的结合。研究显示,AHR可以直接与孤儿受体COUPTF1相互作用,COUPTF-1可能是通过竞争性结合到DNA的DRE上来调节AHR的。有研究表明,在配体结合后,会通过降解来迅速下调AHR。异种生物激活的AHR在从细胞核转运到细胞质后,会被泛素/蛋白酶体系统降解。由于AHR的降解对于AHR活性的调节非常重要,因此确定AHR降解的生理位置对于将来的研究仍然很重要(参考资料8和9)。
AHR还与其他信号通路有相互作用,例如由雌激素受体和其他激素受体、低氧、NF-κB和Rb介导的那些信号通路。与AHR通路互相关联研究最多的可能是类固醇激素受体相关通路。也有人提供了AHR与ESR、AR和甲状腺激素受体途径相互作用的证据。AHR的激活会导致ESR数量和ESR反应性降低,同样会导致ESR代谢的增加。
在没有雌激素的情况下,激动剂激活的AHR-ARNT复合物可以直接与ESR-Alpha和ESR-Beta结合,从而导致ERE依赖性基因的转录激活。结合配体的AHR的这种ERE依赖性雌激素作用,需要核内AHR-ARNT复合物与未结合配体的ESR和辅因子p300/CBP直接相互作用。相反,在存在雌激素的情况下,结合配体的AHR则表现出了抗雌激素作用,其主要是通过抑制与雌激素结合ESR介导的DNA的结合来实现的。
AHR还与NF-KappaB信号通路相互作用。AHR和RelA(NF-κB亚基)之间的直接相互作用诱导了c-Myc蛋白的反式激活(参考资料2、10和11)。AHR与NF-KappaB信号通路之间的功能性相互作用主要是通过与共同的共激活因子SRC1和p300/CBP的相互作用而引起的。AHR和NF-KappaB RelA形成没有活性的复合物,从而导致相互抑制。AHR和RelA之间的相互作用为功能拮抗作用提供了理论基础。有研究发现PKC途径的调节也会影响AHR信号转导。不过,尚未有研究发现AHR与PKC途径蛋白之间的直接相互作用,也没有发现任何AHR复合蛋白会被PKC磷酸化。
AHR还可能通过生长因子信号传导,细胞周期停滞和凋亡而参与细胞周期调控。AHR可能还通过生长因子信号通路、细胞周期阻滞和凋亡来参与细胞周期调控。由于仍未发现AHR反式激活的机制,并且相互依存的蛋白-蛋白相互作用的复杂性,AHR与各种细胞信号级联通路之间的相互作用研究进展缓慢。AHR调控的已知基因启动子区域的分析,有助于阐明AHR在胚胎发育和细胞稳态中的作用。
人类与其他物种AHR信号通路的比较研究,可能会发现物种特异性的AHR机制,也有可能会发现AHR在进化上保守的内源性作用。最后,由AHR介导的非转录事件是否在生物学和毒理学中起重要作用还有待研究(参考资料1、12和13)。
1. Bock KW, Kohle C. Ah receptor: Dioxin-mediated toxic responses as hints to deregulated physiologic functions. BiochemPharmacol. 2006 Mar 16 PubMed ID: 16545780
2. Hestermann EV, Brown M. Agonist and chemopreventative ligands induce differential transcriptional cofactor recruitment by aryl hydrocarbon receptor. Mol Cell Biol. 2003Nov;23(21):7920-5. PubMed ID: 14560034
3. Fujii-Kuriyama Y, Mimura J. Molecularmechanisms of AhR functions in the regulation of cytochrome P450 genes. BiochemBiophys Res Commun. 2005 Dec 9;338(1):311-7. Epub 2005 Aug 30. PubMed ID:16153594
4. Mulero-Navarro S, Carvajal-Gonzalez JM,Herranz M, Ballestar E, Fraga MF, Ropero S, Esteller M, Fernandez-Salguero PM. Thedioxin receptor is silenced by promoter hypermethylation in human acutelymphoblastic leukemia through inhibition of Sp1 binding. Carcinogenesis. 2006Jan 12; PubMed ID: 16410262
5. Tojo M, Matsuzaki K, Minami T, Honda Y,Yasuda H, Chiba T, Saya H, Fujii-Kuriyama Y, Nakao M. The aryl hydrocarbon receptor nuclear transporter is modulated by the SUMO-1 conjugation system. JBiol Chem. 2002 Nov 29;277(48):46576-85. Epub 2002 Sep 26. PubMed ID: 12354770
6. Beischlag TV, Wang S, Rose DW, TorchiaJ, Reisz-Porszasz S, Muhammad K, Nelson WE, Probst MR, Rosenfeld MG, HankinsonO. Recruitment of the NCoA/SRC-1/p160 family of transcriptional coactivators bythe aryl hydrocarbon receptor/aryl hydrocarbon receptor nuclear translocatorcomplex. Mol Cell Biol. 2002 Jun;22(12):4319-33. PubMed ID: 12024042
7. Wang F, Samudio I, Safe S. Transcriptionalactivation of cathepsin D gene expression by 17beta-estradiol: mechanism ofaryl hydrocarbon receptor-mediated inhibition. Mol Cell Endocrinol. 2001 Feb14;172(1-2):91-103. PubMed ID: 11165043
8. Bernshausen T, Jux B, Esser C, Abel J,Fritsche E. Tissue distribution and function of the Aryl hydrocarbon receptorrepressor (AhRR) in C57BL/6 and Aryl hydrocarbon receptor deficient mice. ArchToxicol. 2005 Oct 5;:1-6 PubMed ID: 16205913
9. Klinge CM, Jernigan SC, Risinger KE, LeeJE, Tyulmenkov VV, Falkner KC, Prough RA. Short heterodimer partner (SHP)orphan nuclear receptor inhibits the transcriptional activity of arylhydrocarbon receptor (AHR)/AHR nuclear translocator (ARNT). Arch BiochemBiophys. 2001 Jun 1;390(1):64-70. PubMed ID: 11368516
10. Yang X, Liu D, Murray TJ, Mitchell GC,Hesterman EV, Karchner SI, Merson RR, Hahn ME, Sherr DH. The aryl hydrocarbonreceptor constitutively represses c-myc transcription in human mammary tumorcells. Oncogene. 2005 Nov 24;24(53):7869-81. PubMed ID: 16091746
11. Safe S, Wormke M, Samudio I. Mechanismsof inhibitory aryl hydrocarbon receptor-estrogen receptor crosstalk in humanbreast cancer cells. J Mammary Gland Biol Neoplasia. 2000 Jul;5(3):295-306.Review. PubMed ID: 14973392
12. Ruby CE, Leid M, Kerkvliet NI. 2,3,7,8-Tetrachlorodibenzo-p-dioxinsuppresses tumor necrosis factor-alpha and anti-CD40-induced activation ofNF-kappaB/Rel in dendritic cells: p50 homodimer activation is not affected. MolPharmacol. 2002 Sep;62(3):722-8. PubMed ID: 12181450
13. Mimura J. Biological role of AhR signaling pathway. Seikagaku. 2004 Apr;76(4):359-63. PubMed ID: 15162962














