蛋白降解靶向嵌合体(Proteolysis-Targeting Chimeras, PROTACs),是一种新的具有良好前景的药物类型,其结构类似于哑铃,通过一个连接子(linker)连接 “靶蛋白的配体”以及“E3泛素连接酶的招募配体”。换言之,PROTAC分子的一端与兴趣靶蛋白结合,另一端与E3泛素连接酶结合。而E3泛素连接酶可通过将一种叫做泛素的小蛋白“粘贴”在靶蛋白上,将靶蛋白标记为缺陷或受损蛋白。之后,利用细胞内在的蛋白“粉碎机”(即26S蛋白酶体)可以识别和降解被标记的靶蛋白。PROTACs技术最大的优势之一是能够使潜在靶点从“无成药性”(undruggable)变成“有成药性”。大多数传统小分子药物的原理是结合酶或受体的活性位点来发挥作用,然而PROTACs可以通过任何角落位置抓住靶蛋白。
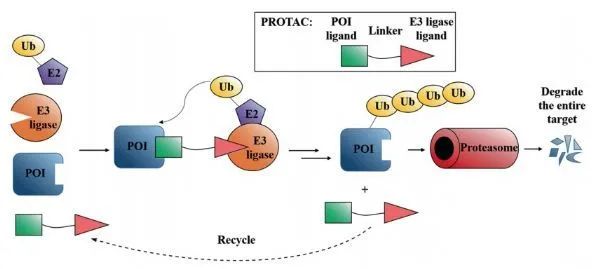
PROTACs发挥作用模式图
本文整理了近期关于PROTACs的文章供大家参考。 (1)Cell:建立开放可获取的靶向激酶降解数据资源集2 来自Dana-Farber癌症研究所的Eric S. Fischer, Nathanael S. Gray以及韩国科学技术研究所Taebo Sim团队在Cell杂志上发表的一项研究中,绘制了首张可降解激酶图谱,鉴定出了大约200种可被降解的激酶,相比之前文献报道的57种有了大大提高,并建立了开放获取的数据集。 此外作者还对影响靶向蛋白降解效率的关键变量进行了探索,发现与激酶亲和力最高的分子并不是降解最有效的,其他因素如三元复合物形成、靶蛋白表达丰度、泛素连接酶以及连接子的设计等也非常重要。作者最后还发现蛋白酶体对于大多数激酶的降解是依赖于p97蛋白的。这项工作可以促进激酶降解剂的研发以及加速它们开发用于癌症和其他疾病治疗的新策略。 (PMID: 33275901 DOI: 10.1016/j.cell.2020.10.038) (2)Nature:小分子发挥PROTACs功能导致BCL6蛋白降解3 来自Dana-Farber癌症研究所的 Eric S. Fischer 和 哈佛大学Benjamin L. Ebert 团队在 Nature 发表论文,发现小分子 BI-3802 竟起到了类似 PROTAC 的蛋白降解作用,通过泛素—蛋白酶体途径特异性实现BCL6蛋白降解。加入BI-3802后可以在细胞内诱导BCL6形成焦点(foci),在体外可以促使BCL6蛋白形成规则的螺旋丝状形态。进一步通过CRISPR-Cas9筛选作者鉴定到E3连接酶SIAH1在该过程中发挥重要作用,BI-3802引起BCL6聚合并与SIAH1的结合增强,导致其快速降解。 (PMID: 33208943 DOI: 10.1038/s41586-020-2925-1) (3)J Am Chem Soc:开发基于抗体的PROTACs实现免疫检查点蛋白PD-L1的靶向降解4 来自加州大学旧金山分校药物化学系的James A. Wells 团队在JACS上发表论文,开发了一种降解细胞表面蛋白的新策略。作者通过筛选获得基于双特异性抗体的PROTACs(antibody-based PROTACs, AbTACs),命名为AC-1,AC-1可以分别或同时结合RNF43和PD-L1,从而实现细胞膜结合的E3连接酶RNF43的招募以及细胞膜表面免疫检查点PD-L1的靶向降解,敲除内源性RNF43或者加入溶酶体降解抑制剂后,PD-L1的降解受到了显著抑制,蛋白酶体抑制剂则不能抑制该过程。该工作为新型蛋白降解药物的设计提供了实验基础,拓宽了PROTACs的应用范围。 (4)Nucleic Acids Res: 浙江大学药学院建立线上PROTACs数据库(PROTAC-DB)5 侯廷军课题组长期关注计算机辅助药物分子设计研究中存在的技术难点和问题,聚焦基于靶点结构的虚拟筛选方法和成药性理论预测,进而展开了系统和深入的方法学研究,并把发展的方法用于多个重要靶点的药物分子设计,发现多类全新结构的抗肿瘤和抗炎症先导化合物。本文中,为了促进PROTACs的合理设计,作者开发出一个基于web的、集结构信息和实验数据为一体的开放访问数据库PROTAC-DB。 目前,PROTAC-DB包括1662个PROTACs、202个弹头(针对感兴趣的蛋白质的小分子)、65个E3配体(能够招募E3连接酶的小分子)和806个连接子,以及它们的化学结构、生物活性和理化性质。除了弹头和E3配体的生物活性外,PROTAC-DB还提供了PROTACs的降解能力、结合亲和力和细胞活性。 (PMID: 33010159 DOI: 10.1093/nar/gkaa807) (5)Nat Chem Biol:PROTACs介导的降解揭示了Aurora A激酶的非催化功能6 Aurora激酶是一种参与细胞有丝分裂的丝氨酸/苏氨酸蛋白酶,人类Aurora激酶包括A、B、C三个亚型。Aurora A在癌症中经常被过度表达,但目前全球尚无Aurora A激酶抑制剂获批上市,这可能与Aurora A除了具有良好的催化活性外,还有非催化功能。德国维尔茨堡大学的Elmar Wolf团队设计了多个针对Aurora A的PROTACs,其中JB170可以特异性导致Aurora A的蛋白降解。有趣的是,该方法和激酶抑制诱导了不同的细胞表型,激酶抑制诱导细胞发生G2/M阻滞,而JB170降低了细胞周期S期的进展,表明Aurora A参与调控细胞周期S期可能不依赖激酶活性。同时作者还发现JB170可以导致癌症细胞发生凋亡,为临床靶向Aurora A治疗癌症提供了理论和实验基础。 (PMID: 32989298 DOI: 10.1038/s41589-020-00652-y) (6)ACS Central Science:PROTACs技术先驱Craig M. Crews教授开发靶向KRAS降解剂7 来自耶鲁大学的Craig M. Crews教授是PROTACs技术的先驱,其创立的Arvinas公司开发的全球首个PROTAC药物ARV-110,已经进入临床I期研究阶段,主要是选择性靶向降解雄性激素受体,用于治疗去势抵抗性前列腺癌(下篇文章中会详细介绍国内外PROTAC药物研发布局)。在本文中,作者首次报道了内源性KRASG12C降解剂LC-2的开发,利用MRTX849作为PROTACs的“弹头”,并使用了VHL E3连接酶的配体,可以持续有效特异地诱导多种细胞系中KRASG12C降解。为靶向KRAS突变体治疗癌症迈出了重要一步。 (PMID: 32875077 DOI: 10.1021/acscentsci.0c00411) 参考文献 1、Sun, X. et al. PROTACs: great opportunities for academia and industry. Signal Transduct Target Ther 4, 64, doi:10.1038/s41392-019-0101-6 (2019). 2、Donovan, K. A. et al. Mapping the Degradable Kinome Provides a Resource for Expedited Degrader Development. Cell 183, 1714-1731 e1710, doi:10.1016/j.cell.2020.10.038 (2020). 3、Slabicki, M. et al. Small-molecule-induced polymerization triggers degradation of BCL6. Nature 588, 164-168, doi:10.1038/s41586-020-2925-1 (2020). 4 、Cotton, A. D., Nguyen, D. P., Gramespacher, J. A., Seiple, I. B. & Wells, J. A. Development of Antibody-Based PROTACs for the Degradation of the Cell-Surface Immune Checkpoint Protein PD-L1. Journal of the American Chemical Society 143, 593-598, doi:10.1021/jacs.0c10008 (2021). 5、Weng, G. et al. PROTAC-DB: an online database of PROTACs. Nucleic acids research 49, D1381-D1387, doi:10.1093/nar/gkaa807 (2021). 6、Adhikari, B. et al. PROTAC-mediated degradation reveals a non-catalytic function of AURORA-A kinase. Nature chemical biology 16, 1179-1188, doi:10.1038/s41589-020-00652-y (2020). 7、Bond, M. J., Chu, L., Nalawansha, D. A., Li, K. & Crews, C. M. Targeted Degradation of Oncogenic KRAS(G12C) by VHL-Recruiting PROTACs. ACS Cent Sci 6, 1367-1375, doi:10.1021/acscentsci.0c00411 (2020).














