信号通路是研究药物作用机制的基础,全面学习和了解信号通路的组成是药学研究必不可少的一个环节。本期开始,我们将对18种重要的信号通路进行梳理。第一期我们首先讲解一种重要的酶联受体—RTKs及其与配体作用的通路。
01
分类
受体酪氨酸激酶(RTKs)是最大的一类酶联受体,它既是生长因子的受体,也是能够催化下游靶蛋白磷酸化的酶。正常情况下,生长因子-RTKs介导的细胞信号通路参与正常细胞的生理功能;但是,肿瘤发生时能够促进肿瘤的发生发展。
RTKs目前报道共有58种,可分为20个家族,包括大名鼎鼎的EGFR家族、PDGFR家族、VEGFR家族等。而目前发现的能够激活RTKs的生长因子则超过100种。(注:在这里我们将所有能够激活RTKs的统称为“生长因子”)。
下表是RTKs的分类:
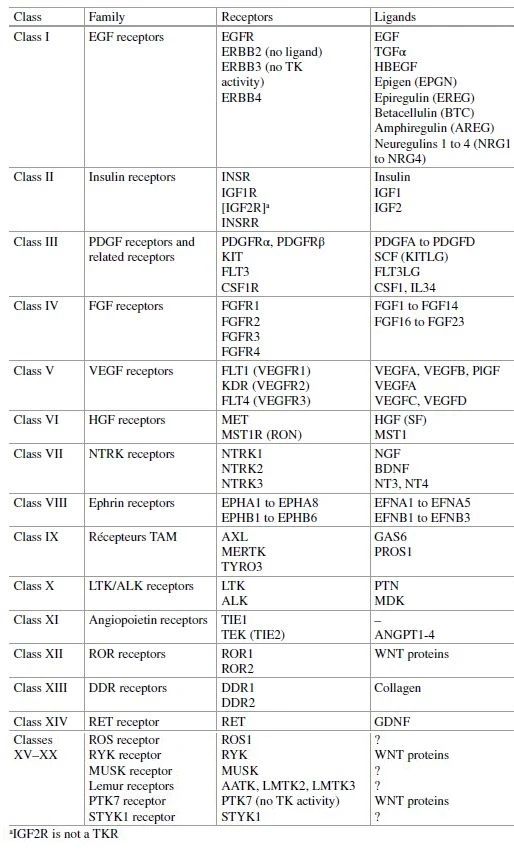
图 1. RTKs共有20个家族
02
结构与功能
所有的RTKs均由三个部分组成:含有配体(生长因子)结合位点的细胞外结构域、单次跨膜的疏水α螺旋区以及含有酪氨酸蛋白激酶活性的胞内结构域(TK domain)。
其中,RTKs的细胞外部分包含多种具有特定氨基酸序列(富半胱氨酸结构域、酸性结构域、免疫球蛋白样结构域等)的结构域。如下图所示:上方是不同RTK家族受体对应的配体,下方是每一个RTK家族受体的示意图。
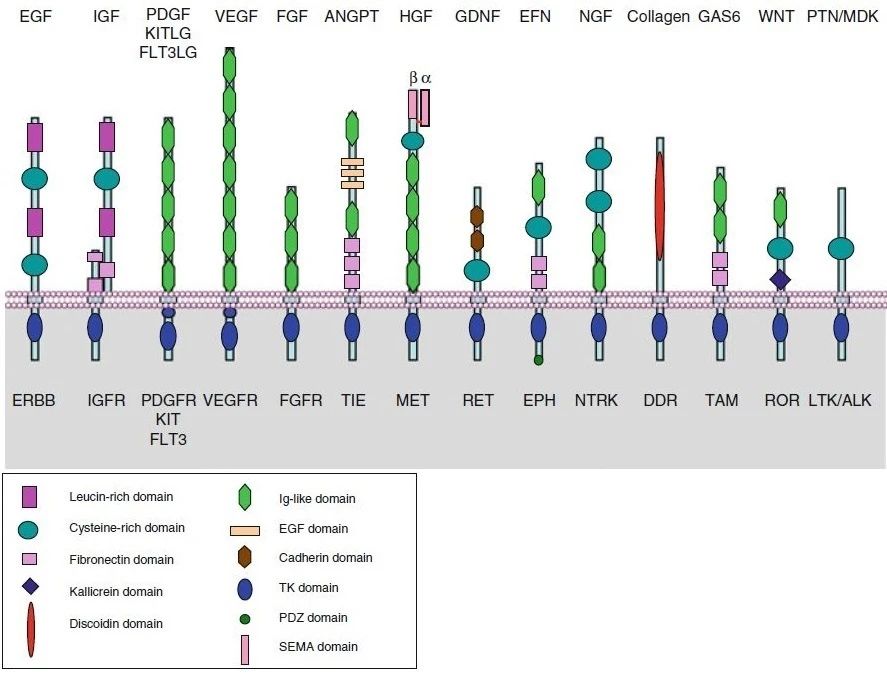
图 2. 不同家族RTK的结构简图
RTKs的激活机制大致都是相同的:配体结合胞外结构域后,两个RTK分子首先在膜上发生二聚化。二聚化之前,RTK激酶催化位点封闭,无法接触ATP(下图a);二聚化以后,ATP可以进入其中一分子RTK的催化位点(下图b),并发挥激酶活性催化另一分子RTK磷酸化。以EGF激活EGFR二聚化为例,具体过程见下图。
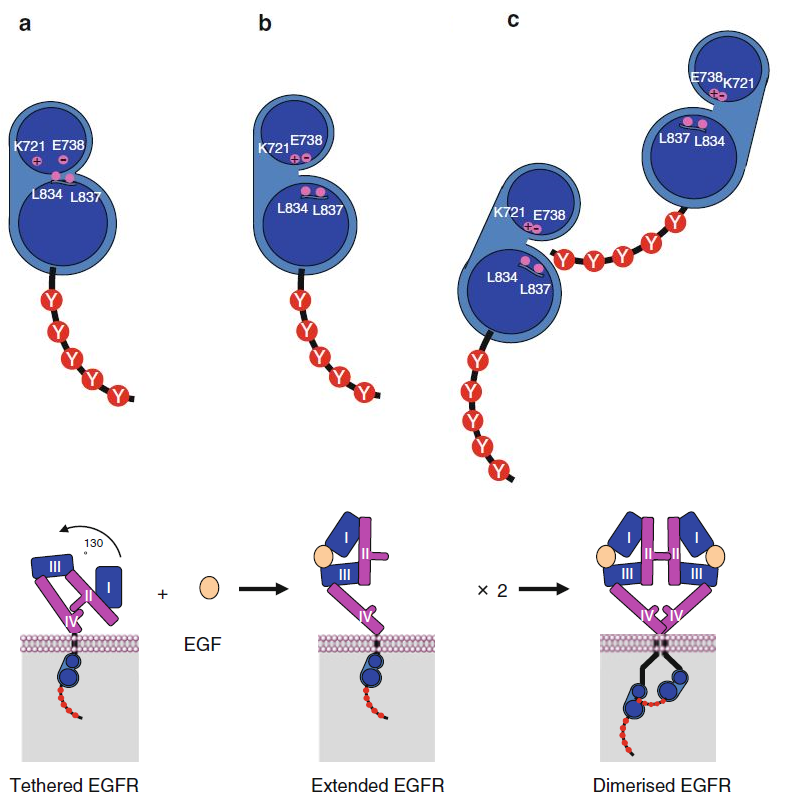
图 3. 两分子RTK发生二聚化的过程;
上图是TK 结构域附近的具体细节;
下图是以EGFR为例的整体过程;
RTK的酪氨酸残基磷酸化后,能够被下游含有SH2结构域或含有磷酸酪氨酸结合结构域(PTB 结构域)的下游蛋白识别。目前含有SH2结构域的下游蛋白已经鉴定超过100种,而带有PTB结构域的下游蛋白已经鉴定出35种。识别后,RTK再次发挥激酶作用,将自身的磷酸转移到这两类蛋白上,引起下游的细胞内效应(大多数情况下如此)。这种传递模式包括一些细胞内酪氨酸激酶(即:非受体型酪氨酸激酶),例如:SRC激酶、JAK 激酶;也包括一些酪氨酸磷酸酶,例如SHP1;还包括其他一些需要通过磷酸化发挥活性的蛋白,例如: 磷脂酶C γ(PLCγ)。
比较特殊的是,有一类含有SH2 或 PTB结构域的蛋白识别RTK磷酸化酪氨酸后,不通过RTK磷酸化进一步传递信号,而是作为接头蛋白去偶联RTK和下游蛋白。例如:在RTK-Ras-MAPK信号转导途径中,Grb2(生长因子受体结合蛋白2)的作用就是作为接头蛋白偶联受体酪氨酸激酶和Ras蛋白。另一个例子则是PI3K 通路中的p85调节亚基。
03
以表皮生长因子受体(EGFR)家族为例
EGFR家族受体激活与二聚化
能够激活EGFR家族受体的生长因子目前发现共有11种:EGF、TGFα、amphiregulin (AREG)、epiregulin (EREG)、HBEGF ( heparin-binding EGF )、β-cellulin (BTC)、epigen/ epithelial mitogen (EPGN) 以及四种神经调节蛋白(NRG1-4)。其中,EGF的前体是长达1207个氨基酸、含有9个egf结构域的长链,该长链经金属蛋白酶(如:ADAM17)剪切加工后,最终形成成熟的、带有53个氨基酸的表皮生长因子(EGF)。其他生长因子虽然也是由前体加工而来,但是前体均只含一个egf结构域。
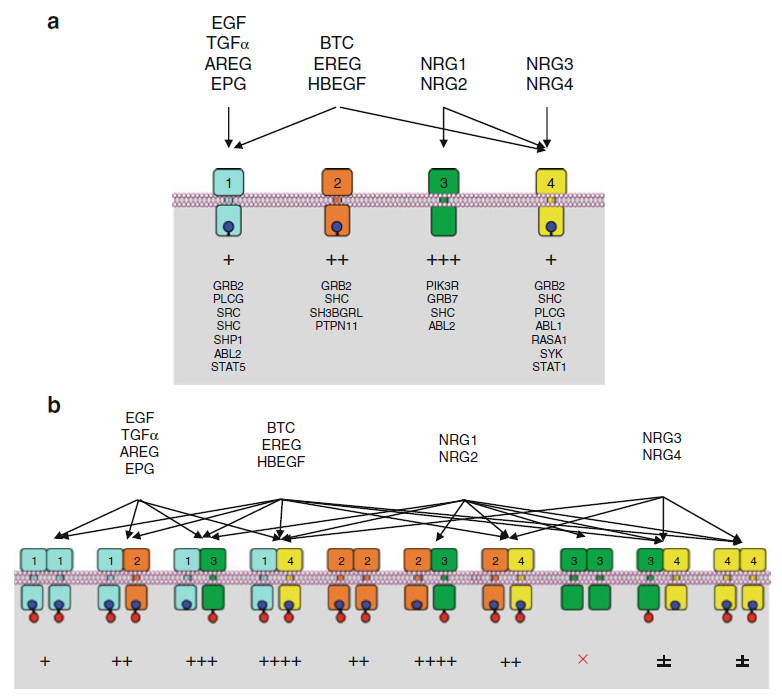
图 4. EGFR家族RTKs与配体的作用模式图
根据上图可以看出:11个配体分别与4个EGFR家族受体作用:EGFR(ERBB1)、HER2(ERBB2)、ERBB3、ERBB4。图a 是二聚化前的情况,每个受体对应下游蛋白也在图中标注出。
值得注意的是, ERBB2(HER2) 并没有相应的配体,因此它一般难以发生同源二聚化,我们称之为“deaf” 受体;而ERBB3则是有配体结合,但是并没有激酶活性,我们称之为“dumb”受体,因为它发生同源二聚化之后不能传递信号,只能与其他ERBB发生异源二聚化,并借助其他ERBB的激酶活性传递信号。
当受体激活而二聚化后(图 b),共有10种二聚化模式。每一条通路的重要性采用“+”进行标记。
在这里我们还要介绍一个现象: ERBB受体内化作用。受体在配体激活后,往往会加速细胞通过胞吞作用将其内化,并转运至溶酶体,最终导致细胞表面的受体在逐步减少。目前认为这一现象主要通过网格蛋白介导。
EGFR家族RTK与肿瘤
EGFR家族受体的异常激活与多种肿瘤相关,也是肿瘤药物研究的重要靶点。例如,EGFR(ERBB1)在多种上皮性肿瘤中异常表达;ERBB1(HER2)在15–25 % 的乳腺癌中高表达,靶向HER2是乳腺癌的一种有效治疗方式。
目前经FDA 批准上市的涉及到EGFR家族受体靶点的药物有:tucatinib(HER2 阳性乳腺癌)、dacomitinib(非小细胞肺癌)、brigatinib(非小细胞肺癌)、neratinib(HER2 阳性乳腺癌)、osimertinib(非小细胞肺癌)、afatinib(非小细胞肺癌)、vandetanib(甲状腺癌)、lapatinib(乳腺癌)、dasatinib(CML)、erlotinib(非小细胞肺癌,胰腺癌)、gefitinib(非小细胞肺癌)。
参考文献:
[1] Robert, Jacques. Textbook of Cell Signalling in Cancer [M]. Springer International Publishing, 2015.
[2] Wagener C , Stocking C , O. Müller. Cancer Signaling - From Molecular Biology to Targeted Therapy[M]. 2017.
[3] Amanda H . Cancer cell signalling[M]. Wiley Blackwell, 2014.
[4] 龙春庭,邵敏,陆小云.激酶小分子抑制剂研究进展.药学学报.














