前言:病毒系统知识点 get,四种主流基因转导病毒工具:腺相关病毒、腺病毒、慢病毒、逆转录病毒的区别优缺点及应用场景
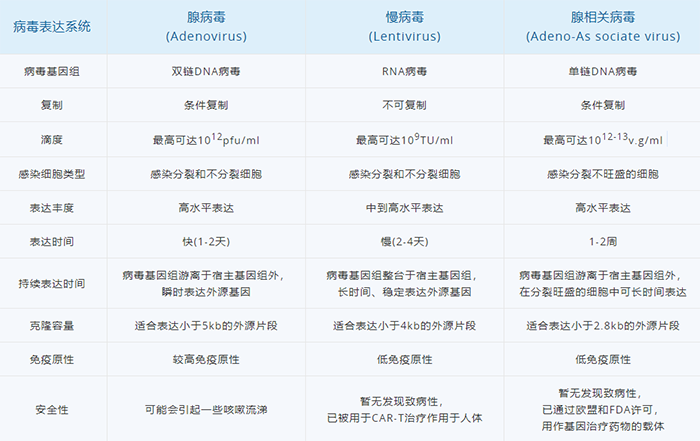
随着病毒生物学的发展,种类繁多的病毒载体已越来越成为向各种实验系统(如细胞系、原代细胞、组织脏器等)转运核酸的重要工具。除了在实验室的组织培养和动物模型生产中发挥重要作用,它们还被用于治疗遗传性疾病的临床试验中。目前主流的病毒载体系统主要包括慢病毒(LV)、(γ-)逆转录病毒(RV)、腺病毒(Ad)和腺相关病毒(AAV)。我们分述之。
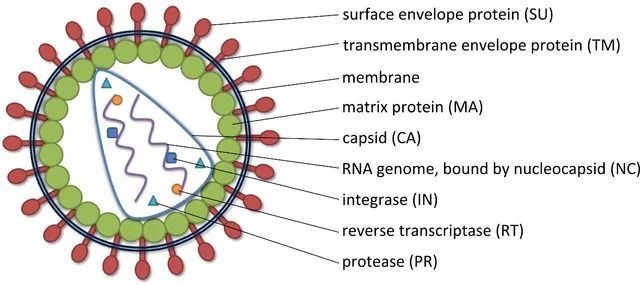
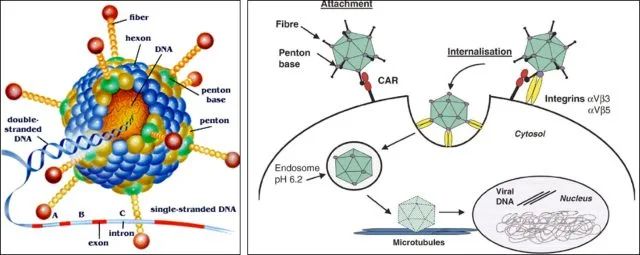
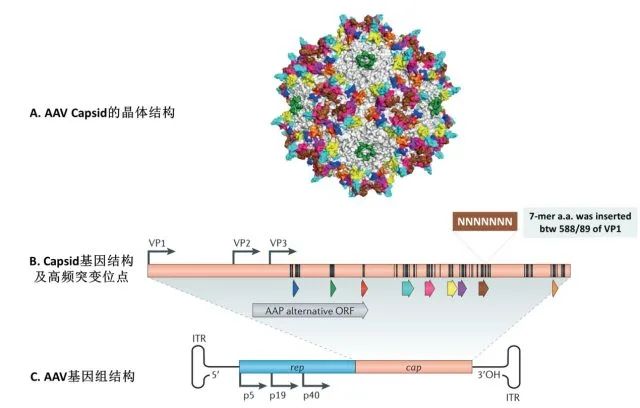
慢病毒和逆转录病毒均属于逆转录病毒科。其典型特征为其 RNA 基因组能逆转录为 cDNA 副本,cDNA 副本又能稳定整合至宿主细胞基因组中(这就是常说的稳转)。逆转录病毒通常分两种:简单的(有时又称为致癌病毒或γ- 逆转录病毒,如鼠白血病病毒)和复杂的(如慢病毒)。这些亚型间主要的差异在于复杂的逆转录病毒存在一些附属基因和调控基因,而简单的则没有(下文有进一步的讨论)。这两类病毒颗粒都含有两份正链 RNA,RNA 上附有病毒反转录酶(RT),它们位于病毒的内核(图 1)。位于内核的还有结构蛋白和酶,包括核壳(NC)、衣壳(CA)、整合酶(IN)和蛋白酶(PR)。内核由一圈外周蛋白层包围,外周蛋白包括基质蛋白(MA),基质蛋白又被来源于宿主细胞细胞膜插有包膜糖蛋白的腹膜所包围 。图 1. 简单和复杂逆转录病毒粒子结构。病毒颗粒含有两份正链 RNA,RNA 上附有反转录酶(RT),它们位于病毒的内核。除此之外,内核还包含核壳(NC)、衣壳(CA)、整合酶(IN)和蛋白酶(PR)。内核由一圈基质蛋白(MA)所包围,基质蛋白又被来源于宿主细胞细胞膜插有包膜糖蛋白(ENV)的腹膜所包围。实验室常用的慢病毒(Lentivirus)载体是以 HIV-1(人类免疫缺陷1型病毒)为基础发展起来的基因治疗载体。具有感染谱广泛、可以有效感染分裂期和静止期细胞、长期稳定表达外源基因等优点,因此成为导入外源基因的有力工具。现在慢病毒系统已经被广泛应用到各种细胞系的基因过表达、RNA 干扰、microRNA 研究以及活体动物实验中。在整合宿主基因组过程中,逆转录病毒(比如 MLV)通常大约 20% 的感染事件发生在转录单位的 5' 端,对 CpG 岛和 DNase I 超敏感位点附近有一定的倾向性。而慢病毒载体多整合到远离转录起始点的位点。因此,与逆转录病毒载体相比,慢病毒载体似乎致癌可能性较低,临床应用可能更安全。重组腺病毒(Adenovirus,Ad)载体系统是一种复制缺陷的腺病毒载体系统,在基因治疗、基础生命科学研究等领域被广泛应用。重组腺病毒具有以下几个显著的优点:感染范围广,几乎可以感染所有的细胞系、原代细胞和部分组织;感染效率高达 100%,全面超越其他病毒载体工具和脂质体转染;对外源基因容载能力大(可以高达 8Kb);不整合基因组;滴度高,操作方便。因此,重组腺病毒是最具有潜力的一种基因递送工具。目前常用的腺病毒载体是基于人腺病毒 5 型(Ad5)的,其基因组是 36Kb 长的线性双链 DNA。腺病毒是通过自身的纤维(Fiber)和细胞表面的受体(如 CAR)结合被内吞进入细胞,然后从内吞体(endosome)转移到细胞质和细胞核内,借助细胞的转录和翻译机器启动病毒的复制组装 (图 2)。一个完整的病毒生活周期会引发细胞死亡从而释放出病毒粒子。目前最常用的腺病毒包装体系有 AdEasy 和 AdMAX 两种,其共同特点是目的基因(GOI)首先克隆到穿梭载体,然后再重组到腺病毒的大骨架上。这两个系统均是腺病毒早期转录复制基因 E1 和 E3 缺陷的 (DE1, DE3),其中 E3 基因对病毒产生并非必需。因此,腺病毒包装必需依赖表达 E1 的细胞系,比如 HEK-293,HEK-293A 等。腺相关病毒(Adeno-Associated Viral Vector,AAV)属微小病毒科 (parvovirus),为无包膜的单链线状 DNA 病毒。只有在腺病毒或者疱疹病毒等辅助病毒协助下,宿主才能产生具有感染性的 AAV,所以 AAV 被称作腺相关病毒。典型的 AAV2 基因组约 4800bp 的单链 DNA- 被二十面体的外壳 -Capsid 包裹。AAV 的基因组包括 2 个反向末端重复序列 (ITR,145 bp) 和两个读码框 (ORF)-Rep 和 Cap(图 1)。ITR 对合成互补 DNA 链是必需的;Rep 和 Cap 可以翻译成多种不同蛋白,如 AAV 生活周期必需的 Rep78、Rep68、Rep52 和 Rep40 以及包膜蛋白 VP1、VP2 及 VP3 等。图 3. AAV 基因组结构与 Capsid(Cap)高频突变位点示意图。A. Capsid 晶体结构示意图。其中蛋白 VP1 表面不同颜色的氨基酸基团代表 Cap 高频突变位点。B. Cap 基因结构。其中 Cap ORF 编码 3 个蛋白 -VP1、VP2 和 VP3。高频突变区域用不同颜色的箭头表示,并对应到图 A 中 Cap 表面不同颜色的氨基酸基团。C. AAV 基因组结构。需要着重提及的是,Capsid 表面一些关键的氨基酸残基(图 1A 中不同颜色的氨基酸)会与细胞表面的受体相互作用,介导 AAV 病毒的特异性感染到目的组织或脏器。目前 AAV 有 12 种血清型、100 多种变体。不同的血清型对组织或器官有着不同的亲和性(图 4)。由于安全性高、免疫原性小、表达周期久等优点,AAV 被称为目前最适合在体研究(in vivo)基因功能的利器。
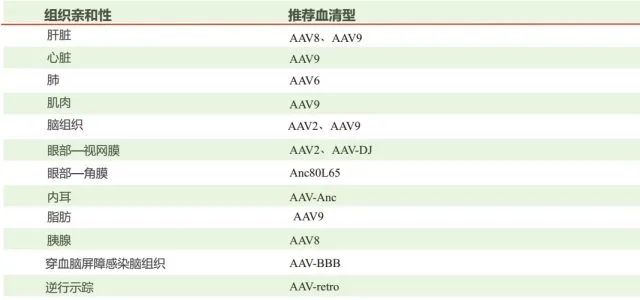 图 4. 不同的 AAV 血清型对组织或脏器的偏爱性。我们综合比较下四种病毒载体系统的特点(表 1):四种主流病毒载体系统的特点比较。a. 是研究原代非增殖细胞基因表达的最佳系统:腺病毒感染细胞后,1-2 天即可表达,是研究原代非增殖细胞基因表达的最佳系统;b. 滴度高:腺病毒系统在转有 E1 基因的 HEK293 细胞中可进行自我复制,可产生滴度为1010 到1011PFU/mL 的病毒;
图 4. 不同的 AAV 血清型对组织或脏器的偏爱性。我们综合比较下四种病毒载体系统的特点(表 1):四种主流病毒载体系统的特点比较。a. 是研究原代非增殖细胞基因表达的最佳系统:腺病毒感染细胞后,1-2 天即可表达,是研究原代非增殖细胞基因表达的最佳系统;b. 滴度高:腺病毒系统在转有 E1 基因的 HEK293 细胞中可进行自我复制,可产生滴度为1010 到1011PFU/mL 的病毒;d. 不整合到染色体中,无插入致突变性:腺病毒除卵细胞以外,几乎在所有已知细胞中都不整合到染色体中,因此避免了因整合而引发的潜在的基因突变和随机效应 。
AAV在基因传递和表达的优势
1.宿主范围广:随时可转染的 AAV 可高效感染分裂和非分裂细胞;2.多种血清型 :AAV1,AAV2, AAV5, AAV6, AAV7, AAV8 和 AAV9 等;3.安全性高:ITR 序列和 rep/cap 基因分别由独立的质粒表达;未发现 AAV 对人体致 病,rAAV 去除了 wtAAV 基因组的96%,进一步保证了安全性;4.免疫原性低:AAV2 的基因组仅 4681 个核苷酸,便于用常规的重组 DNA 技术进行操作,而且进行动物实验时造成的免疫反应小;5.扩散性强:AAV可以穿透血脑屏障,是最理想的神经元和胶质神经下感染工具。
腺相关病毒的局限性有哪些?
1. 体外实验表达水平较低:
主要是因为 rAAV 病毒的基因组是单链 DNA,在体外环境形成双链并转录翻译外源基因的效率非常低。可以在体外水平感染 rAAV 病毒的同时感染辅助病毒比如 Ad5 型腺病毒或者终浓度 10~50 mM 的丁酸钠等方法提高细胞实验的 rAAV 表达量。
2. 需较长时间开始表达:
同样是需要从单链 DNA 变成双链 DNA,rAAV 在感染后需要较长的时间来表达外源基因,所以 rAAV 感染后建议至少 1 周后做切片观察。
3. 载体容量较小:
腺相关病毒载体作为基因治疗的载体,目前最多只能容纳4.7Kb外源DNA片段
慢病毒的优势:
1.慢病毒携带的基因组可整合到宿主基因组,使宿主细胞长时间稳定表达外源基因;
2.可感染分裂和非分裂细胞;
3.低免疫原性,直接注射活体组织不易造成免疫反应,适用于动物实验;
4.可以更换特异性启动子;
5.野生型的HIV大小约为9.8 kb,插入片段可长达5-6 kb;
参考:
http://www.xjishu.com/zhuanli/27/201811262788.html
https://www.genechem.com.cn/index/products/product.html?cid=70
https://zhuanlan.zhihu.com/p/81078684
https://zhuanlan.zhihu.com/p/225769548