在多细胞生物体中,组织和器官的发育是由几个信号通路相互作用控制的,这些信号通路之间会相互作用,从而提供位置信息并诱导细胞特定命运。
WNT(Wingless-Type MMTV Integration Site Family)与TGF-Betas(转化生长因子-β)、FGFs(成纤维细胞生长因子)、Hedgehog和Notch蛋白等分泌因子家族成员一起参与这些过程。WNT基因编码一个分泌蛋白生长因子的大家族,从水螅到人类诸多动物体内都发现了这些因子。Wnt这个名字表示这个家族与果蝇无翅基因Wg(Wingless)及其脊椎动物直系同源基因Int1有关系,Int1是一种小鼠原癌基因。目前,已从各种物种中分离出近100个WNT基因。在人类中,已鉴定出19种WNT蛋白,它们具有27%-83%的氨基酸序列同源性以及23或24个半胱氨酸残基的保守序列。
在发育过程中,Wnt在控制细胞命运、增殖、迁移、极性和死亡方面扮演着不同的角色。在成人中,WNT在维持体内稳态过程中起着重要功能,WNT途径的异常激活与多种癌症有关(参考文献1&2)。
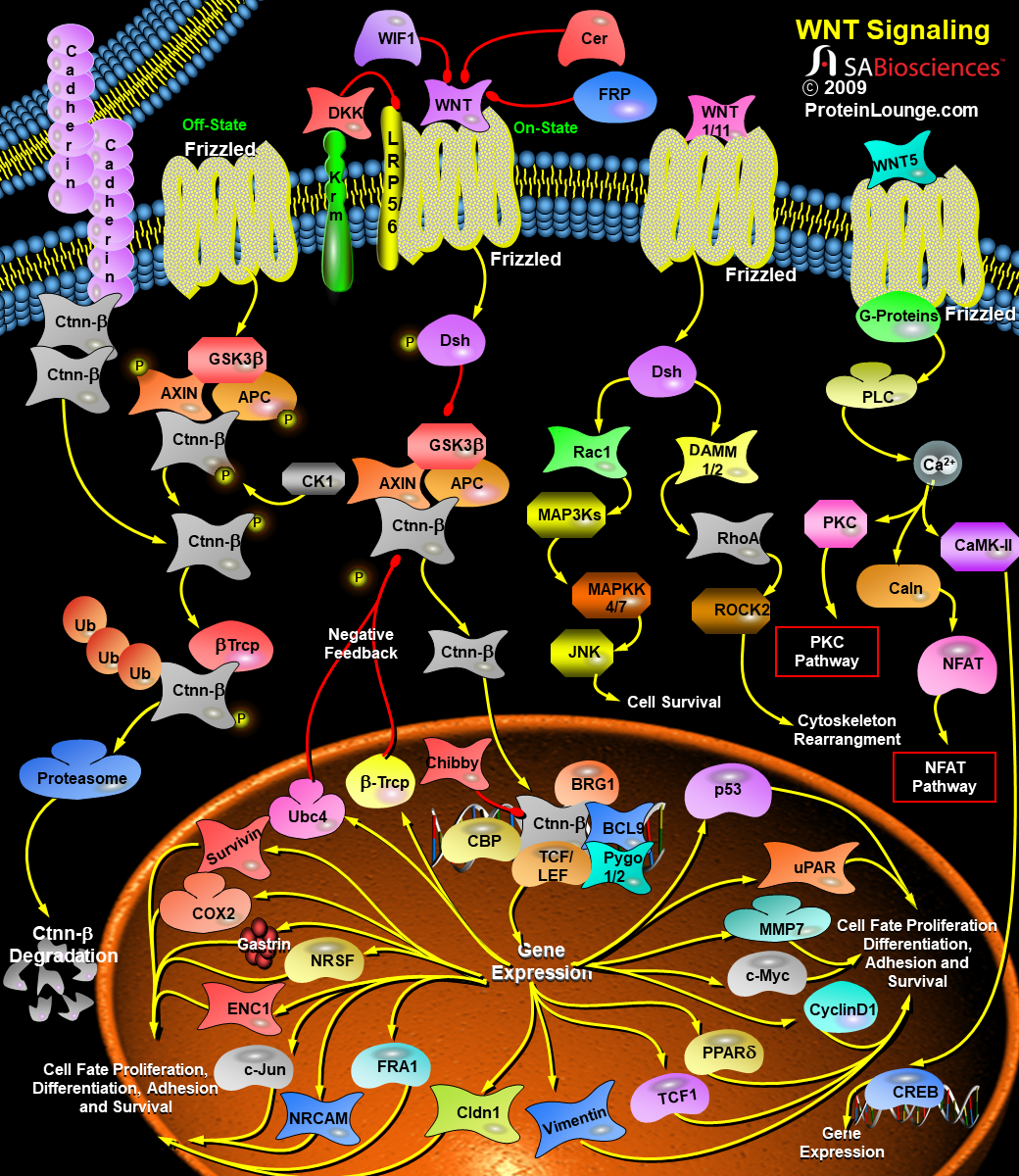
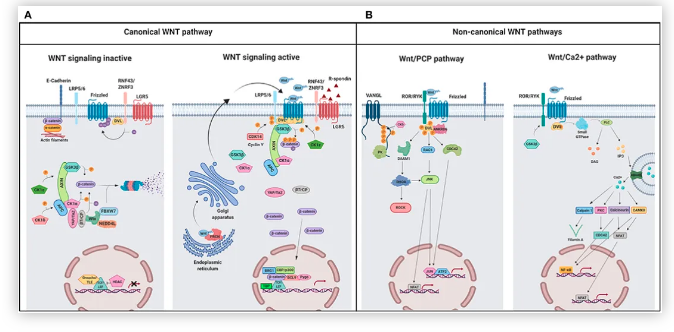
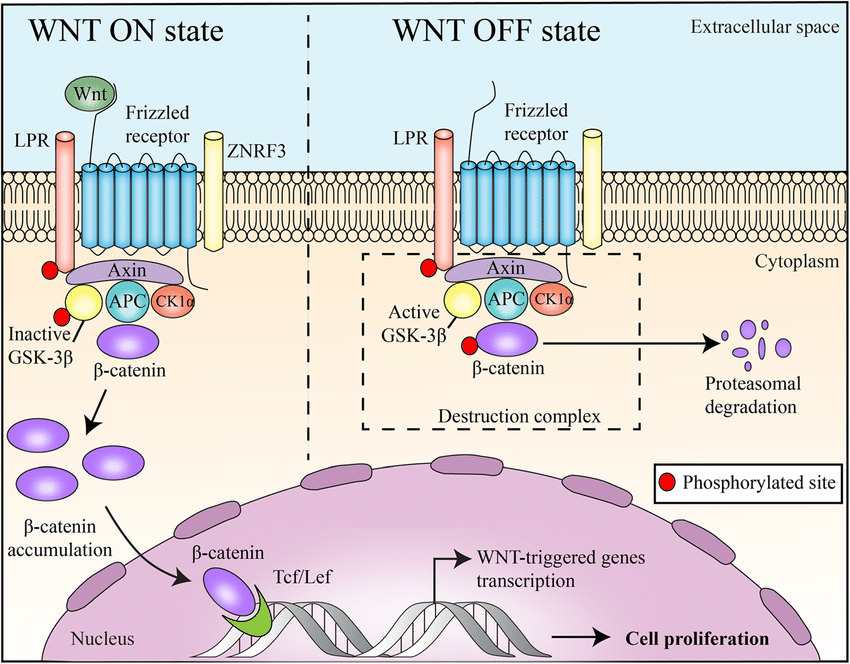
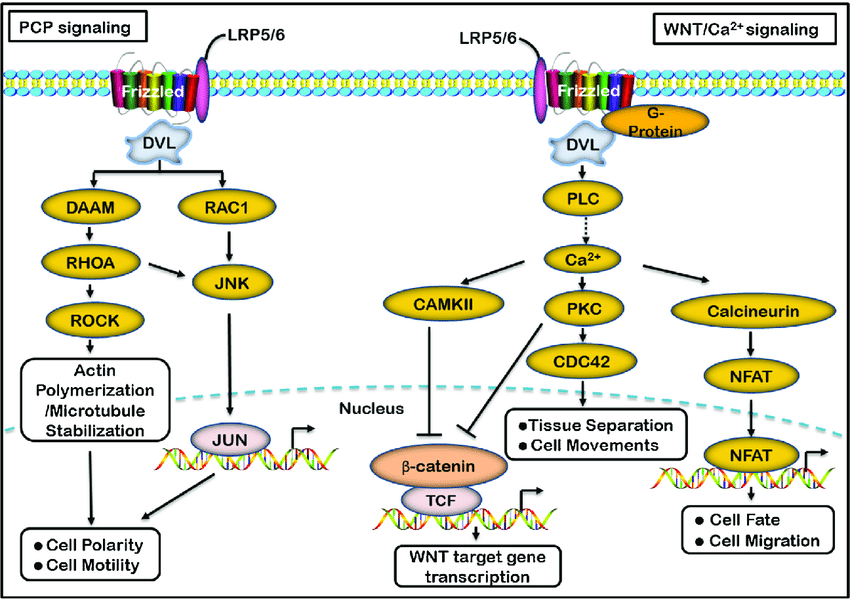
WNT配体通过Frizzled家族的7跨膜受体(人类基因组中有11个成员)以及最近发现的LRP5(脂蛋白受体相关蛋白-5)和LRP6(脂蛋白受体相关蛋白5)共受体传递信号。在结构上,Frizzled受体有一个胞外Wnt结合区、七个跨膜区域和一个胞内C末端尾巴。Frizzled序列所预示的二级结构以及Wnt信号通路蛋白质和GPCRs通路所特有的蛋白的参与表明,Frizzled蛋白也是GPCR家族成员。Wnt信号至少通过三条不同的细胞内通路进行传递,包括经典Wnt/Ctnn-Beta(catenin-Beta)信号通路、“非经典”的Wnt/Ca2+(钙)通路和Wnt/PCP(平面细胞极性)通路。Wnt/Ctnn-Beta通路主要调控发育过程中细胞的命运,而Wnt/极性通路的主要功能是调节细胞骨架组织。Wnt/Ca2+途径的生物学功能尚不清楚(参考文献3)。Wnt/Ctnn-Beta通路是人们最了解的Wnt信号通路,在进化过程中高度保守。WNT/Ctnn-Beta途径由WNT1、WNT3、WNT3a、WNT7a和WNT8激活,并参与转化。在没有Wnt信号的情况下,Beta-Ctnn与含有CK1Alpha(酪蛋白激酶-1-Alpha)、GSK3Beta(糖原合成酶激酶-3-Beta)、Axin(Axis抑制剂)和APC(腺瘤性息肉病结肠)蛋白的细胞质复合物相结合。这促进了Beta-Ctnn的磷酸化及其与Beta-TRCP(Beta-转导蛋白重复序列蛋白)的相互作用,导致Beta-Ctnn被泛素化,随后被蛋白酶体降解(参考文献1)。在Wnt信号存在的情况下,Wnt与其受体Frizzled结合,从而导致Dsh(Dishevelled)蛋白的激活。在哺乳动物中的所有器官中,Dishevelled蛋白家族成员都含有Dsh1,Dsh2,Dsh3。这些家族成员有三个高度保守的结构域,包括一个N端DIX结构域,名字来源于Dsh和Axin,一个中央PDZ结构域,是Postsynaptic Density-95、Discs-Large和Zonula occludens-1的首字母缩写,以及一个C-末端的DEP。被激活的Dishevelled蛋白增强了GSK3Beta的磷酸化,从而抑制了GSK3Beta,导致游离的未磷酸化Beta-Ctnn在细胞质中积累,然后这些Beta-Ctnn转运到细胞核。在WNT信号转导前的细胞核中,LEF(Lymphoid Enhance Factor)和TCF(T-Cell factor)等与靶基因启动子/增强子区域的特异性序列结合,并与Groucho和CTBP(COOH末端结合蛋白)一起,通常起到抑制基因表达的作用。WNT信号导致核内Beta-Ctnn水平升高,从而与TCF/Lef结合,促进转录机制的改变,从而导致几个靶基因的激活。蛋白质从钙粘附素结合池转移到细胞质池可以增加可用于激活靶基因的游离Ctnn-Beta数量。转录激活是通过Ctnn-Beta与组蛋白乙酰转移酶CBP(CREB结合蛋白)、染色质重塑SWI/SNF复合物以及与Pyg(Pygopus)和BRG1结合的Bcl9相互作用介导的。CHIBBY直接与Ctnn-Beta的C-末端区域相互作用,通过与LEF1竞争结合Ctnn-Beta来抑制Ctnn-Beta介导的转录激活(参考文献4,5和6)。目前已有多个基因被确定为Ctnn-Beta/TCF转录调控的靶基因。其中包括基质金属蛋白酶-7(MMP-7)、尿激酶型纤溶酶原激活剂受体(UPAR)、CD44、c-Myc、c-jun、Fos相关抗原-1(Fos-Related Antigen-1)、细胞周期蛋白D1(Cyclin-D1)、过氧化物酶体增殖性激活受体-δ(PPAR-Delta)、转录因子-1(TCF1)、纤维连接蛋白(FN)、纤连蛋白(Slug)、胃泌素(Gastin)、环氧合酶-2(COX2)和层粘连蛋白5(Laminin 5)的γ2链。此外,TCF/Lef和Ctnn-Beta复合物可能与其他信号通路激活的因子协同作用,改变细胞重塑过程。其中许多基因,包括CCND1和c-Myc,在细胞生长、增殖和分化中起关键作用,并且在结肠癌中被异常激活。Ctnn-Beta诱导的c-Myc基因可诱导p53表达,p53上调p21WAF1和p130/RB2,从而导致细胞生长停滞。Ctnn-Beta的另一个靶点是Vimentin,一种参与细胞迁移的蛋白质。在人乳腺肿瘤细胞中,Vimentin蛋白是CtnnBeta/TCF反式激活途径的直接靶点。WNT信号可通过上调Caspase抑制剂Survivin等抗凋亡蛋白来阻止细胞凋亡,并通过上调血管内皮生长因子(VEGF)来刺激血管生成。一些能够降解细胞外基质的蛋白酶,如Matrilysin/MMP7和MMP26,以及细胞粘附分子,如CD44和NrCAM(神经元细胞粘附分子),都是WNT的靶基因,并且可以促进肿瘤的侵袭和转移。经典WNT信号通路还调控NRSF/REST和ENC1(外胚层-神经皮质(带有BTB样结构域)-1)基因,从而控制祖细胞。Cldn1(Claudin-1)也参与了Ctnn-Beta-TCF/Lef信号通路,Cldn1的高表达可能在大肠癌的发生发展中起一定作用。几个WNT信号通路的靶基因可以编码WNT信号转导系统的组份。beta-TRCP和泛素结合酶UbC4/5E2的表达的增加,可能在WNT信号转导中起负反馈作用,这两个蛋白均参与Ctnn-Beta降解。最近的研究发现Wnt信号通路的抑制剂有四个家族:FRP(Frizzled相关蛋白)、Cer(Cerberus)、WIF1(Wnt抑制因子-1)和Dkk1(Dickkopf-1)。Cerberus和WIF1可直接与WNT相互作用并抑制WNT。FRP通过物理结合WNT及其受体Frizzled来抑制WNT信号通路。Wnt信号也受到分泌蛋白Dkk1的抑制,Dkk1是多基因家族的成员。Dkk1通过与LRP5/6结合并拮抗LRP5/6来抑制Wnt信号。最近有证据表明,跨膜蛋白Krm1(Kremen-1)和Krm2(Kremen-2)是高亲和力的Dkk1受体,与Dkk1在功能上协同阻断Wnt信号。Krm2与Dkk1和LRP6形成三元复合物,并诱导LRP6迅速内吞和从质膜上的移除(参考文献6,7和8)。非经典Wnt信号通路,又称非经典Wnt-Frizzled信号通路,由Wnt/Ca2+通路和Wnt/PCP通路两个细胞内信号级联通路组成。在WNT/Ca2+途径中,WNT蛋白主要由WNT1、WNT5A和WNT11组成,与细胞表面的Frizzled跨膜受体结合,参与几个细胞过程,这些过程涉及刺激异三聚体G蛋白,从而进一步激活PLC(磷脂酶-C)。PLC导致细胞内Ca2+释放增加,环鸟苷酸(CGMP)水平降低,CaMKII(Ca2+-钙调蛋白依赖性蛋白激酶-II)或Caln(钙调神经磷酸酶)和PKC(蛋白激酶-C)两种激酶被激活。这些过程可以刺激核因子NFAT和其他转录因子,如CREB(cAMP Response Element-Binding Protein-1)。因此,Wnt/Ca2+通路很可能是G蛋白依赖的信号通路(参考文献3&9)。在Wnt/PCP途径中,Wnt蛋白与细胞表面的Frizzled跨膜受体结合,然后通过Dsh激活Rho/Rac小GTPase和JNK(Jun N端激酶),随后辅助细胞骨架组织和基因表达的调控。DSH通过Daam1连接到下游效应器Rho和ROCK(Rho关联激酶)。RAC由Dsh直接激活,Dsh通过分别激活MAP3Ks(丝裂原活化蛋白激酶)和MAP2Ks丝裂原活化蛋白激酶(MAP2Ks)进一步激活JNK。WNT靶基因NKD(Naked)的产物最近被鉴定为WNT信号的拮抗剂,它与Dsh结合,阻断Ctnn-Beta,但刺激JNK途径(参考文献3,10和11)。Wnt-Frizzled信号通路在神经系统发育的生物学中起着重要作用。特别是,Wnt-Frizzled信号通路参与了神经板与神经前体细胞的发育以及随后的神经管的前后延伸。最终,WNT-Frizzled信号通路导致大脑、脊髓的发育,以及感觉和运动神经元的众多亚群的延伸。WNT-Frizzled通路的功能障碍可能导致神经退行性疾病,如阿尔茨海默病和心力衰竭。通过进一步鉴别和靶向控制WNT-Frizzled信号通路的关键元件,可以更好地理解WNT-Frizzled信号通路的生物学潜能,从而开发针对神经退行性疾病和血管疾病的新的治疗方案(参考文献12&13)。
1. Li F, Chong ZZ, Maiese K. Windingthrough the WNT pathway during cellular development and demise. HistolHistopathol. 2006 Jan;21(1):103-24. PubMed ID: 162677912. Katoh M, Katoh M. Comparative genomicson Wnt5a and Wnt5b genes. Int J Mol Med. 2005 Apr;15(4):749-53. PubMed ID:157540423. Li F, Chong ZZ, Maiese K. Vital elementsof the Wnt-Frizzled signaling pathway in the nervous system. Curr NeurovascRes. 2005 Oct;2(4):331-40. PubMed ID: 161811244. Urano T. Wnt-beta-catenin signaling inbone metabolism. Clin Calcium. 2006 Jan;16(1):54-60. PubMed ID: 163973515. Souaze F, Viardot-Foucault V, Roullet N,Toy-Miou-Leong M, Gompel A, Bruyneel E, Comperat E, Faux MC, Mareel M, RosteneW, Flejou JF, Gespach C, Forgez P. Neurotensin receptor 1 gene activation by theTcf/{beta}-catenin pathway is an early event in human colonic adenomas. Carcinogenesis.2005 Nov 19; PubMed ID: 162993836. Blavier L, Lazaryev A, Dorey F,Shackleford GM, DeClerck YA. Matrix metalloproteinases play an active role in Wnt1-inducedmammary tumorigenesis. Cancer Res. 2006 Mar 1;66(5):2691-9. PubMed ID: 165105897. Kikuchi A, Kishida S, Yamamoto H. Regulationof Wnt signaling by protein-protein interaction and post-translationalmodifications. Exp Mol Med. 2006 Feb 28;38(1):1-10. PubMed ID: 165205478. Mao B, Wu W, Davidson G, Marhold J, LiM, Mechler BM, Delius H, Hoppe D, Stannek P, Walter C, Glinka A, Niehrs C. Kremenproteins are Dickkopf receptors that regulate Wnt/beta-catenin signalling. Nature.2002 Jun 6;417(6889):664-7. Epub 2002 May 26. PubMed ID: 120506709. Kohn AD, Moon RT. Wnt and calciumsignaling: beta-catenin-independent pathways. Cell Calcium. 2005Sep-Oct;38(3-4):439-46. PubMed ID: 1609903910. Goldstein B, Takeshita H, Mizumoto K,Sawa H. Wnt signals can function as positional cues in establishing cellpolarity. Dev Cell. 2006 Mar;10(3):391-6. PubMed ID: 1651684111. Katoh M. WNT/PCP signaling pathway andhuman cancer. Oncol Rep. 2005 Dec;14(6):1583-8. PubMed ID: 1627326012. Timm A, Grosschedl R. Wnt signaling inlymphopoiesis. Curr Top Microbiol Immunol. 2005;290:225-52. PubMed ID: 1648004513. Janssens N, Janicot M, Perera T. TheWnt-dependent signaling pathways as target in oncology drug discovery. InvestNew Drugs. 2006 Jan 28; PubMed ID: 16444610