2021年6月份发表在Cell Death & Differentiation (IF=10.719)上的综述Molecular mechanisms of cell death in neurological diseases。在这篇综述中,作者简要概述了程序性细胞死亡(PCD,Programmed Cell Death),包括细胞凋亡、坏死性凋亡、细胞焦亡、铁死亡以及与自噬和非程序性坏死相关的细胞死亡过程,以及它们在导致大脑神经退行性疾病或肿瘤发生中的作用。此外,作者还讨论了不同的细胞死亡信号级联和疾病发病机制之间的相互作用,并描述了针对已进展到临床试验的细胞死亡信号通路中的关键参与者的药物制剂。在多细胞生物组织稳态的正常发育和维持过程中,以及消除受损、感染或衰老的细胞过程中PCD是必需的,这些过程依赖于严密调控的PCD信号事件。自1972年细胞程序性自杀的超微结构特征被确定以来,以细胞凋亡(apoptosis)“代称”的PCD逐渐进入科学家的视野,这些超微结构特征包括:细胞质收缩、核浓缩和分裂以及在生理或某些病理条件下在各种组织中明显的凋亡小体的形成。已经有一些抗凋亡和促凋亡蛋白家族成员能够调节该途径,例如抗凋亡蛋白(BCL-2、BCL-XL、MCL-1、BCL-W和A1/BFL1)、细胞凋亡关键抑制蛋白(BAX和BAK)。由大脑和脊髓组成的中枢神经系统也是由PCD塑造的,其中在时间和空间水平上严格调节的信号事件促进了神经结构的建立。在正常的神经胚胎和出生后发育中,细胞凋亡是PCD的主要形式。细胞凋亡会影响不同的细胞群,包括神经前体细胞、神经元和神经胶质细胞,确保只有大小和形状正确并与其轴突和神经突建立适当连接的细胞才能存活。虽然去除多余的神经元细胞对正常脑功能至关重要,但不同神经元细胞群的异常死亡是与神经退行性疾病相关的病理学标志,例如肌萎缩侧索硬化、阿尔茨海默病、帕金森病和亨廷顿病。相反,大脑中神经元细胞或其他细胞类型的PCD缺陷被认为会促进脑癌的发展,例如高度侵袭性的多形性胶质母细胞瘤。本文重点帮助大家梳理了所有的细胞死亡形式及分子水平的变化。细胞死亡途径包括细胞凋亡(Apoptosis)、坏死性凋亡(Necroptosis)、自噬(Autophagy)、铁死亡(Ferroptosis)、细胞焦亡(Pyroptosis)、坏死(Necrosis),它们具有不同的形态和生化特征相关(参见图1)。例如,细胞凋亡通常与细胞收缩有关,而坏死性凋亡则涉及细胞肿胀和细胞内容物泄漏,后面展开详细论述。
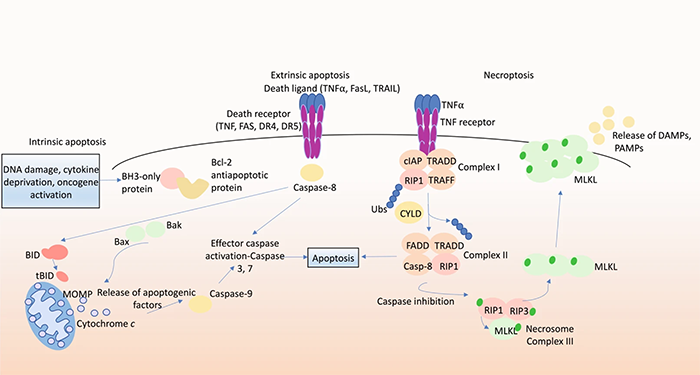
细胞凋亡可以被两个不同的通路触发:内源性的线粒体途径(BCL-2途径)和外源性的死亡受体途径。(图2)内源性途径由 BCL-2 蛋白家族的促凋亡和抗凋亡成员调节。在健康细胞中,抗凋亡蛋白BCL-2、BCL-XL、MCL-1、BCL-W和A1/BFL1通过抑制BAX 和BAK的基本效应来保证细胞存活。当细胞处于应激状态(例如生长因子剥夺、DNA损伤、ER应激)时,BH3-only 蛋白(BIM、PUMA、BID、BMF、BAD、HRK、BIK、NOXA)作为细胞凋亡的关键启动子,会呈现出转录或转录后层面的上调,与抗凋亡BCL-2蛋白以高亲和力结合,释放BAX和BAK并形成寡聚体,导致线粒体外膜通透性增加,线粒体释放cytochrome c和Smac/DIABLO等凋亡因子,这些凋亡因子促进半胱天冬酶级联反应的激活,导致数百种蛋白质的裂解,最终导致细胞破坏。外源性途径通过肿瘤坏死因子受体超家族成员的配体激活,这些家族成员具有细胞内死亡结构域,促进了细胞内死亡诱导信号复合物的形成,导致caspase-8和下游效应器半胱天冬酶(caspase-3和caspase-7)的激活。死亡受体途径可以通过caspase-8介导的促凋亡蛋白BID的蛋白水解过程激活从而与内源性凋亡通路连接到一起。在肌萎缩性侧索硬化中,运动神经元丢失会导致肌肉萎缩和虚弱、肌肉抽搐、痉挛,通常会因呼吸衰竭而死亡。超氧化物歧化酶1(SOD1)的突变约占家族性ALS病例的20%,SOD1突变会导致线粒体表面与抗凋亡蛋白BCL-2结合进而抑制BCL-2活性,此外有证据表明BIM 缺乏可以延长SOD1突变小鼠的寿命。在阿尔兹海默症中,细胞可以通过p53依赖性转录上调BAX以及下调BCL-2和 BCL-XL来诱导细胞凋亡。在亨廷顿病小鼠模型疾病晚期的脑裂解物中,促凋亡因子BIM和BAX的水平增加。帕金森病相关的Parkin突变体泛素化BAK的能力降低,表明这会导致BAK介导的细胞凋亡增加,Caspase抑制剂在体外帕金森病模型中显示出神经保护作用,内源性凋亡途径的异常激活可能导致帕金森病神经元死亡的主要驱动因素。在胶质母细胞瘤中,BCL-2和BCL-XL常表现出更高的水平,高水平的BCL-XL与胶质母细胞瘤患者的快速进展和较差的存活率相关,因此BCL-XL被提议作为这种恶性肿瘤治疗抵抗的标志物。坏死性凋亡是PCD的一种细胞裂解形式,并且可导致炎症。当caspase-8的活性被药物或病毒抑制剂阻断时,TNFR1、TLR等受体的刺激可诱导坏死性凋亡,涉及受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1)的自磷酸化激活。RIPK1激活RIPK3,之后RIPK3磷酸化并激活下游MLKL,这是导致细胞膜裂解的坏死性凋亡的末端效应物。这促进了损伤相关的分子模式、病原体相关分子模式的释放,这些内源性分子的释放促进了炎症反应。在ALS中,坏死性凋亡对于运动神经元变性并不是必要的,有科学家观察到MLKL缺失不影响SOD1突变小鼠的疾病发作、进展和存活。相比之下,在对来自人类AD患者的大脑进行死后检查时,有证据表明存在坏死性凋亡,与健康对照的大脑相比MLKL表达更为丰富。此外,我们认为坏死性凋亡会加剧AD小鼠模型的认知缺陷,用RIPK1抑制剂necrostatin-1治疗可以减少神经元死亡,减弱了皮质和海马中不溶性淀粉样斑块和过度磷酸化tau蛋白的形成,并改善了认知损害。然而,值得注意的是,除了诱导坏死性凋亡外,RIPK1和RIPK3还参与激活caspase-8介导的细胞凋亡以及细胞因子和趋化因子的产生。目前尚不清楚通过 necrostatin-1抑制这些过程中的哪一个会减缓小鼠模型的病理特征改变。在AD小鼠模型中对RIPK1进行药理学抑制或基因敲除可降低淀粉样蛋白负荷、降低炎性细胞因子水平和改善记忆障碍,因此RIPK1被认为是该疾病治疗干预的有希望的靶点。在PD的临床前模型中,MLKL或RIPK3的基因敲除或RIPK1的药理学抑制发挥了神经保护作用,减少了多巴胺能神经元变性并改善了运动表现。此外,在人类PD患者的死后脑活检中发现了经磷酸化而激活的MLKL。在PD的OPA1突变组织培养模型中,RIPK1抑制剂治疗可保护iPSC衍生的神经细胞免受PD的影响。坏死性凋亡在HD发病机制中的作用的证据是有限的,迄今为止,还没有关于HD患者死后样本中坏死性凋亡信号蛋白表达的报道。在中风动物模型中,用RIPK1抑制剂necrostatin-1治疗或对坏死性凋亡至关重要的蛋白质进行基因敲除,可改善神经功能并减少脑损伤后的神经元细胞死亡,但缺乏对患者坏死性凋亡抑制剂的临床效用的研究,这一领域值得关注进一步的调查。在癌症中,有自相矛盾的报道声称坏死性凋亡可以促进或抑制肿瘤生长,这可能取决于癌症的类型或坏死性凋亡是否发生在恶性细胞或肿瘤微环境细胞中。在头颈部鳞状细胞癌中,与健康组织相比,RIPK1表达下调,而在肺癌患者和肺癌小鼠模型中,RIPK1表达在肿瘤组织中显着升高。在一项针对GBM患者的研究中,约30%的肿瘤表现出高水平的RIPK1表达,这与不良预后相关。在级别较低的胶质瘤患者中,RIPK3表达水平较高的患者预后较差。在另一项研究中,GBM 患者中MLKL的上调与不良预后相关。因此,RIPK1、RIPK3和MLKL的表达增加似乎可能促进肿瘤生长,这可能与肿瘤微环境细胞中的坏死性凋亡驱动血管生成和炎症有关,促进癌细胞增殖和转移。有学者观察到胶质母细胞瘤细胞对细胞凋亡具有高度抵抗力,坏死性凋亡的激活或PCD的替代机制可能代表探索癌症治疗的有希望的途径,RIPK1、RIPK3和MLKL的激活剂可能是潜在的治疗方法。
4.与自噬相关的细胞死亡(Cell death associated with autophagy)自噬是大分子结构甚至整个细胞器降解过程中的高度保守的步骤,在细胞和组织稳态中起关键作用,对于调节蛋白质的细胞质周转和整个细胞器的很重要。营养缺乏、氧化应激和蛋白质聚集等许多刺激都可以启动细胞自噬。在这些情况下,自噬减少了细胞压力,并为细胞提供了用于修复、存活和生长的代谢物。根据细胞内底物进入溶酶体腔的方式不同,自噬可分为三大亚型:大自噬(macro-autophagy)、微自噬(micro-autophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy)。这些自噬方式都集中在溶酶体上,用于细胞内容物降解和回收。尽管自噬通常用于促进细胞存活,但在某些情况下,例如果蝇发育过程中唾液腺的退化,自噬与细胞杀伤有关。在ALS中,SQSTM1、OPTN、TBK1、VCP和C9ORF72等与自噬相关基因的突变,与该疾病的家族遗传背景有关,自噬体在ALS患者脊髓神经元细胞质中的积累。在SOD1突变的ALS小鼠模型中,Atg7的丢失在早期会加速疾病进展,而在疾病晚期则会减缓疾病进展并延长寿命。在AD中,自噬体在神经元中的积累是AD在动物模型和患者中的一个显着特征。来自 AD 患者或对照的死后脑组织的海马锥体神经元的芯片测序分析揭示了AD早期自噬相关基因的高表达。增强自噬可能是实现AD神经保护结果的一个有前景的研究领域。自噬缺陷与支持PD的几种分子机制有关,并且几种ATG基因在PD中被证明是异常的。因此,已经在PD患者的脑组织和PD动物模型中发现了失调的自噬,这表明自噬在疾病发病机制中发挥作用。在HD中,亨廷顿蛋白(HTT)的积累与自噬减弱有关。值得注意的是,在果蝇和HD小鼠模型中,通过抑制哺乳动物雷帕霉素信号传导靶点来增强自噬可以增强HTT聚集体的清除并降低毒性。矛盾的是,在HD小鼠模型中,p62(一种自噬受体)的消融显着能减弱核内含物的形成和运动缺陷并延长了寿命。这些报告举例说明了在HD中靶向自噬信号的复杂性。因此,需要大量的额外工作来更好地理解自噬在HD发病机制中的作用。自噬在GBM中的作用是有争议的,一些报道声称它抑制肿瘤生长,而另一些报道称它促进肿瘤生长。在U343神经胶质瘤细胞中,自噬被证明会触发细胞衰老,这也增强了TMZ诱导的神经胶质瘤细胞衰老。自噬可抑制GBM细胞迁移和侵袭,逆转上皮间质转化。另一方面,自噬对肿瘤产生积极影响,增加其增殖潜力,p62表达升高与GBM患者较差的生存相关。据报道,在GBM中经常发生突变的EGFR、PTEN和AKT的扰动会影响自噬的调节。自噬也被证明可以促进GBM细胞的存活并促进转移。鉴于自噬在胶质母细胞瘤中的作用的持续争议,如果应利用该途径对该疾病进行治疗干预,则有必要进一步研究。铁死亡在2012年首次被提出,是指铁依赖性坏死的一种PCD形式。铁死亡的最终结局是压倒性的脂质过氧化,导致细胞完全衰竭。尽管铁死亡表现出以前通常称为氧化应激诱导的细胞死亡的许多特征,但有许多方面足以将其区分为一种独特的细胞死亡形式,例如铁死亡在形态和功能上与一般氧化应激不同。ACSL4和LPCAT3等许多铁死亡相关的分子成分已经被确定,它们产生容易过氧化的膜脂,以及为细胞提供谷氨酸-胱氨酸逆向转运蛋白系统xCT来保证细胞所必需的半胱氨酸。铁死亡诱导剂包括GPX4抑制剂(RSL3、ML210、ML162、FIN56、FINO2)、谷胱甘肽合成中断剂(丁硫氨酸亚砜亚胺)、xCT系统抑制剂(埃斯汀、索拉非尼、柳氮磺吡啶、谷氨酸盐)、铁。铁死亡的内源性抑制剂包括谷胱甘肽、泛醌、维生素E和硒。许多小分子抑制剂具有氧化还原活性,并表现出直接抑制脂质过氧化的巨大潜力。当我们试图描绘铁死亡的其他分子方面时,一个潜在问题是此类抑制剂可能直接抑制脂质过氧化,而与其预期目标的相互作用无关,比如黄芩素等脂氧合酶抑制剂具有氧化还原活性。因此,氧化还原活性分子的使用应与补充实验方法相结合,以便清楚地解释结果。鉴于越来越多的证据表明铁死亡在许多条件下的作用,这需要重新评估先前涉及具有氧化还原活性和抑制脂质过氧化作用的抑制剂的研究。目前我们很难确定铁死亡在疾病环境中的作用的具体证据。几乎所有的神经退行性疾病似乎都表现出脂质过氧化。同样,铁稳态失调和谷胱甘肽减少也是神经变性的常见特征。据报道,经典RTA铁死亡抑制剂liproxstatin-1和ferrostatin-1在中风小鼠模型、PD和HD切片培养测定中表现出良好功效。维生素E可防止Gpx4基因敲除小鼠的神经元快速死亡,而GPX4的过表达可防止大鼠发生脑内出血。临床上已经评估了几种铁死亡抑制剂。在AD的 II 期临床试验中,铁螯合剂去铁胺显著降低了患者认知能力下降的速度。令人惊讶的是,尽管去铁胺鼻腔制剂在AD动物模型中显示出前景,但这项研究在30年后仍未被重视。与去铁胺类似,去铁酮在体外抑制铁死亡,并在AD、PD和ALS小鼠模型中表现出功效。在PD的两项II期试验中,去铁酮显着影响脑铁水平,并且根据UPDRS的测量显着延迟或趋于减缓症状的进展。有140名参与者的第三项II期试验已经完成但尚未报告,而有372名参与者的第四项 II 期试验目前正在进行中。铁死亡相关基因表达与胶质瘤的诊断和预后因素相关。许多抗癌药物似乎靶向并增强铁死亡过程靶点以杀死神经胶质瘤细胞,包括双氢青蒿素和布洛芬。诱导铁死亡被认为可以增强传统抗癌治疗的效果,这些治疗会触发细胞凋亡等其他细胞死亡途径。用铁喂养患有胶质母细胞瘤的小鼠或大鼠可增强放射治疗的影响。此外,erastin或柳氮磺吡啶对xCT系统的抑制增强了替莫唑胺的疗效。使用RNA干扰抑制 COPZ1通过增强铁蛋白吞噬作用来增加细胞内铁含量,从而抑制肿瘤生长并提高小鼠的存活率。相反,由中性粒细胞引发的铁死亡导致的胶质母细胞瘤细胞坏死被证明与恶化的结果相关。总体而言,铁死亡的影响似乎取决于许多因素。铁死亡可能会杀死癌细胞,但不是免疫沉默的,我们需要思考这可能对周围健康组织产生什么影响。
细胞焦亡是PCD的一种炎症形式,涉及炎症小体对caspase-1的激活,caspase-1通过蛋白水解将pro-IL-1β和 pro-IL-18分别加工成成熟的炎性细胞因子IL-1β和IL-18。GSDMD是细胞焦亡的关键执行者,在被caspase-1切割后其N端片段组装成质膜孔,从而允许释放生物活性IL-1β、IL-18以及其他细胞内容物。细胞焦亡表现出表现出质膜起泡的形态,因此通常被认为是单核细胞特异性的细胞凋亡形式。然而,最近发现的GSDMD及其成孔活性已将细胞焦亡重新定义为细胞死亡的一种坏死形式。许多神经退行性疾病,包括AD、PD、ALS、HD、多发性硬化、中风和创伤性脑损伤,都有细胞焦亡(伴有炎性小体激活和IL-1β和IL-18升高)的证据报道。在多发性硬化的动物模型中,发现了小胶质细胞和少突胶质细胞的炎性小体激活和焦亡,其中病理特征改变通过抑制caspase-1减缓。坏死通常被认为是一种非程序化的、不受调节的细胞死亡过程,其特征是细胞肿胀、生物膜完整性丧失、细胞内容物溢出和离子梯度的消散,从而引发炎症反应。缺氧、冷冻或灼烧、病原体刺激、物理化学应激、缺血再灌注和钙超载等来自细胞外部的过度刺激,可能会诱导细胞发生坏死。坏死的早期事件包括细胞内钙离子增加、活性氧浓度增加,最终导致不可逆的细胞损伤。然而,与坏死性凋亡不同,坏死缺乏明确的核心细胞信号转导机制,但最近Ninj1被确定为对质膜破裂至关重要,此外Ninj1对于在坏死性凋亡、细胞焦亡和继发性坏死期间发生的质膜破裂也同样至关重要, 在许多病理条件下观察到坏死,包括心肌梗塞、中风、几种神经退行性疾病和某些癌症,其中坏死恶性细胞释放的因子可能会影响肿瘤微环境。在神经退行性疾病中,例如中风时血管闭塞的直接损伤等组织损伤,实际上是由不受控制的坏死引起的,而不是任何一种程序性细胞死亡途径。这种组织损伤只能通过防止或减少病理损伤(例如在中风期间增加灌注)来减轻。尽管如此,神经退行性疾病中的大部分继发性组织破坏很可能是由细胞凋亡和坏死性PCD途径的相互作用引起的。所以,由于细胞有能力参与多个PCD过程,因此针对这些过程的药物似乎需要联合使用才能取得良好的效果。不同细胞死亡途径的调节器和效应器仍然是有吸引力的治疗靶点,它们可能构成转化医学的基础,有望改善患有这些疾病的患者的临床治疗。鉴于复杂的神经系统疾病的病因,其中多种细胞死亡机制通常与其他细胞过程相结合从而共同驱动病理进展,有效的疗法似乎可能包括一种以上细胞死亡程序的抑制剂和其他细胞过程的抑制剂。图4显示了已进入临床试验的细胞死亡途径中的一些关键靶标。

许多脑部疾病与PCD的一个或多个过程中的缺陷有关:在神经退行性疾病中本应存活的细胞的异常杀伤,或者在脑癌的发展和治疗过程中本应死亡的细胞的异常存活。在大多数神经退行性疾病中,尚未明确定义这些细胞死亡缺陷真正的原因。在脑癌中,与所有类型的癌症一样,有效递送任何类型细胞死亡的有效诱导剂预计会导致肿瘤缩小,当然前提是对于正常组织而言是安全的。细胞焦亡在神经退行性疾病发病机制中扮演着重要角色。除此之外,已有研究发现以炎症小体形成、caspase-1激活以及GSDMD N和C末端分离为特征的细胞焦亡可能与炎症性肠病(IBD) 发病机制有关,NEK7与NLRP3 相互作用以调节 NLRP3 炎性体激活,从而调节 MODE-K 细胞中的细胞焦亡和 DSS 诱导的小鼠慢性结肠炎。心血管疾病(CVD),尤其是动脉粥样硬化和心肌梗塞,通常伴随着细胞死亡和急性/慢性炎症反应。半胱天冬酶依赖性细胞焦亡的特征是激活导致 NOD 样受体激活的通路,尤其是 NLRP3 炎性体及其下游效应炎症因子白细胞介素 (IL)-1β和IL-18。过去十年中的许多研究都调查了细胞焦亡在 CVD 中的作用。这些研究的结果导致了基于焦亡调节的治疗方法的发展,其中一些方法正在临床试验中。不仅如此,细胞焦亡在川崎病、帕金森等疾病中,同样被报道发挥着重要的作用。这些研究都为探索疾病与细胞焦亡提供了强有力的理论基础。



