大家好,这次给大家分享的文献是A newly defined risk signature, consisting of three m6A RNA methylation regulators, predicts the prognosis of ovarian cancer,2020年9月发表在Aging杂志上,影响因子4.831。本文从18个m6A RNA甲基化调节因子出发,筛选与卵巢癌(OC)预后显著相关的3个m6A RNA甲基化调节因子。
摘要
背景:N6-甲基腺苷(m6A) RNA甲基化,涉及癌症的发生和发展,由m6A RNA甲基化调节剂动态调节。然而,m6A RNA甲基化调节因子在卵巢癌中的表达及其与预后的相关性仍不清楚。
方法:这里作者证明了卵巢癌和正常组织之间有18个中心m6A RNA甲基化调节因子存在差异表达。通过应用一致性聚类,基于所有18个m6A RNA甲基化调节因子的总体表达水平,将所有卵巢癌患者病例分为三个亚组(聚类1/2/3),进而系统分析了18种m6A RNA甲基化调节因子转录水平在卵巢癌中的预后价值,发现IGF2B 1、VIRMA和ZC3H13在预测卵巢癌预后方面得分最高。
结论:因此,作者得出了由这三个m6A RNA甲基化调节剂在转录水平组成的风险特征,作为OC的独立预后标记,并通过来自不同卵巢癌队列的数据验证了这一发现。此外,通过基因集富集分析(GSEA),作者证明了三种选定的调节因子都与癌症通路和WNT信号通路相关。
研究流程图 图1 结果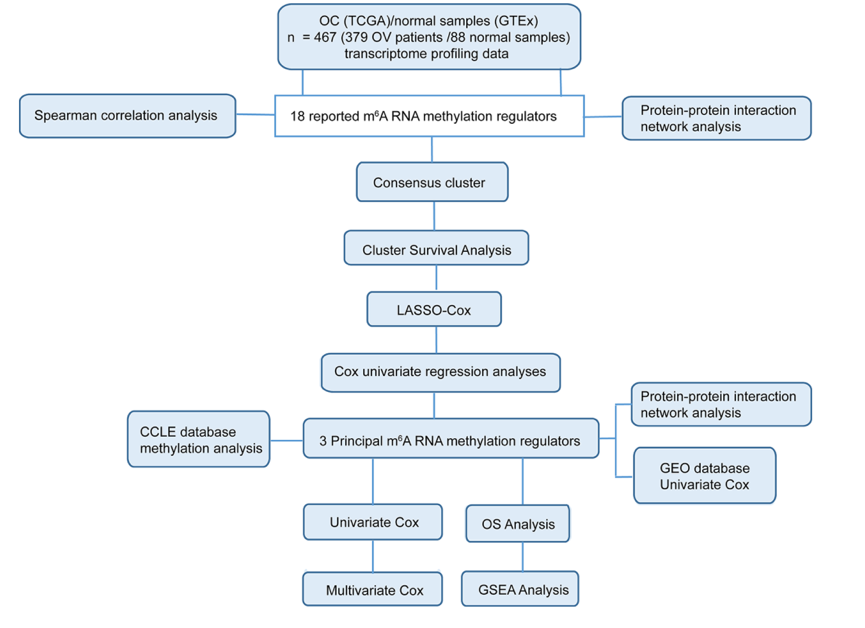
1、18个差异表达的m6A甲基化调控因子(正常VS肿瘤)
为了理解18个m6A RNA甲基化调节剂之间的相互作用,作者对这18个基因进行了相关性分析(基于OV数据集)(图2C)和PPI网络分析(图2D、E)。PPI网络分析表明,WTAP、RBM15、METTL3、METTL14和VIRMA与其他调节因子的联系更多,而IGF2BP2、IGF2BP1、IGF2BP3和ELF3与其他调节因子的相互作用更少(图2D和2E)。在18个m6A RNA甲基化调节因子中,ZC3H13与其他蛋白质的相互作用最多,主要与细胞周期蛋白依赖性激酶(CDKs)家族、RNA聚合酶II (POLR2)家族和介体(MED)复合物家族相互作用。总之,这18个m6A RNA甲基化调节剂中的大多数彼此密切相关。其中,ZC3H13与CDKs、POLR2和MED的相互作用最多。
图2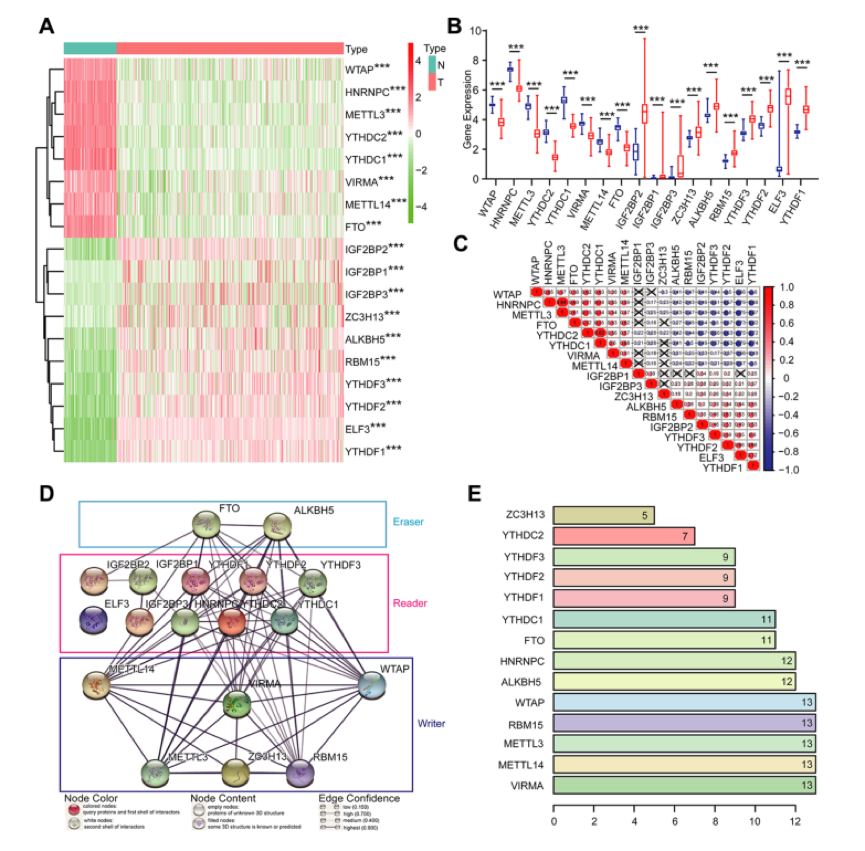
2、 m6A RNA甲基化调控因子的一致聚类识别了三个OC聚类
图3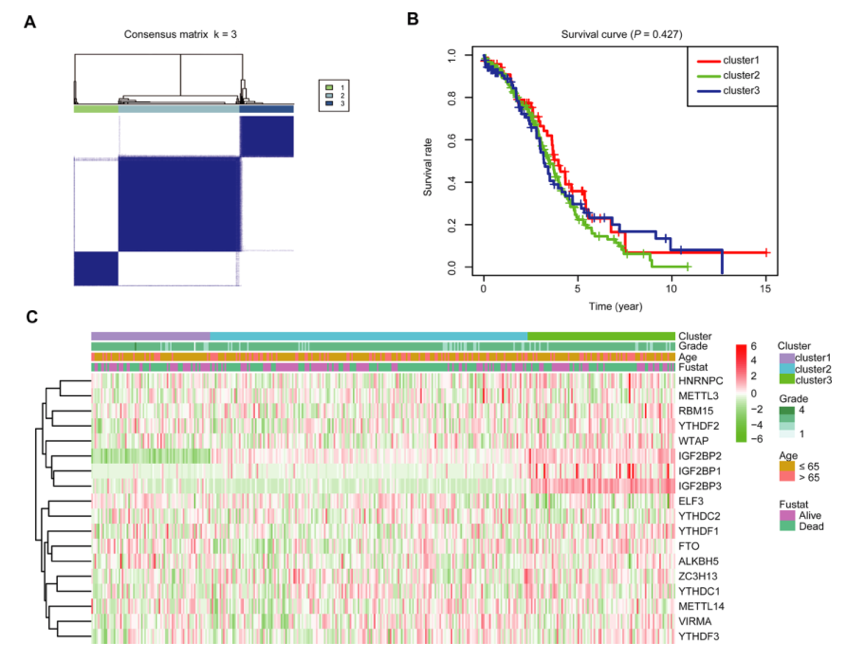
3、由三个m6A RNA甲基化调节剂组成的风险特征
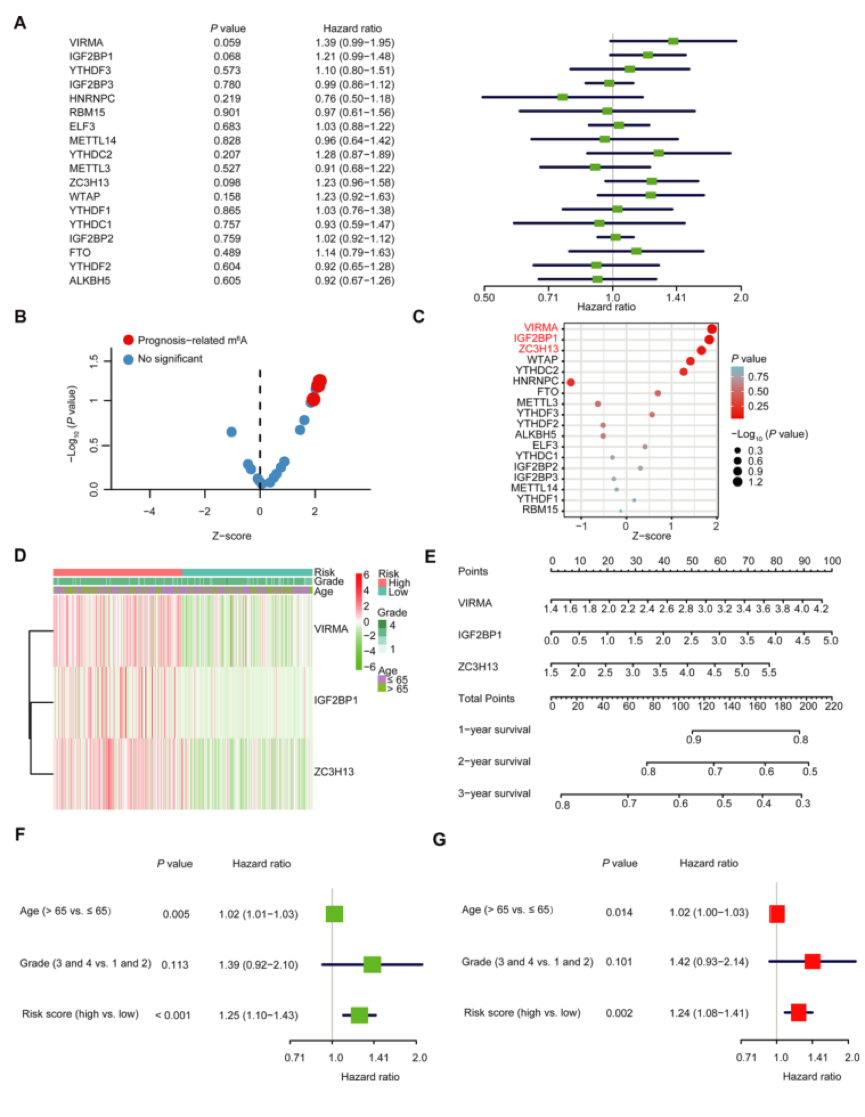
为了研究每个m6A RNA甲基化调节因子在OC中的预后作用,作者对TCGA数据集中每个m6A RNA甲基化调节因子进行单变量Cox回归分析(图5A)。结果表明,18个被测试的调节器中有3个显著与OS相关(图5A–5C)。这三个基因(IGF2BP1、VIRMA和ZC3H13)都是HR > 1的风险基因。因此,作者比较了三种调节因子的临床病理特征(包括肿瘤病理分级和年龄)。很明显,在大多数高危患者中,三种选定的调节因子的表达都很高(图5D)。为了更好的预测,作者建立了一个列线图,该图纳入了三个与OC预后相关的m6A RNA调节因子(图5E)。对所有变量应用单变量Cox回归分析表明,风险评分和年龄都是卵巢癌患者的独立不良预后因素(图5F)。多变量cox回归分析也得到相同的结果(图5G)。
图4 图5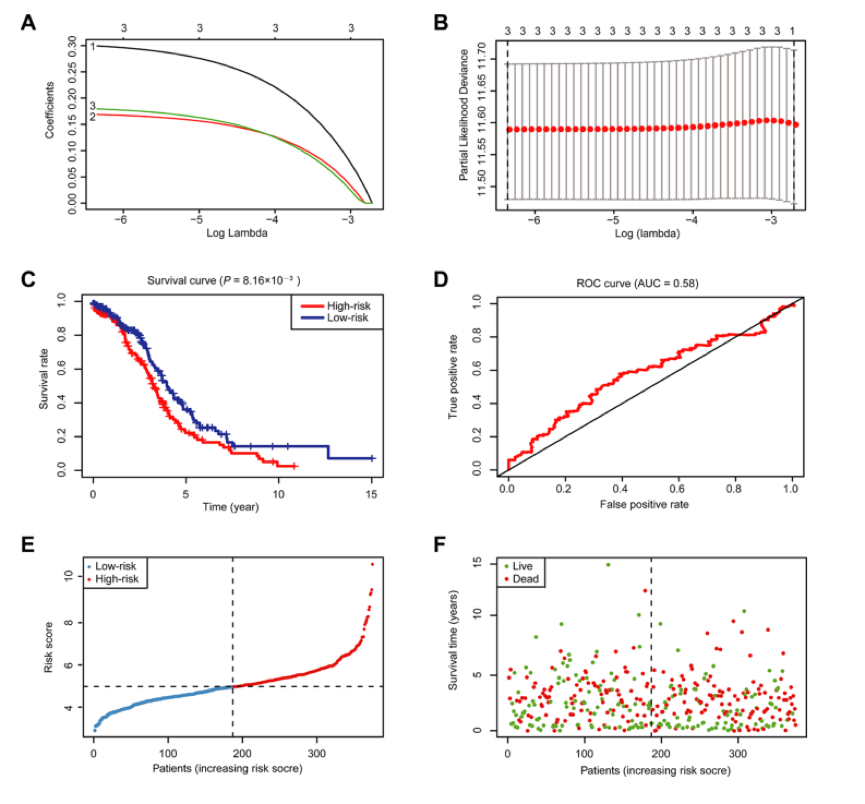
4、不同OC队列数据验证风险特征,并探索它们涉及的信号通路
图6 结语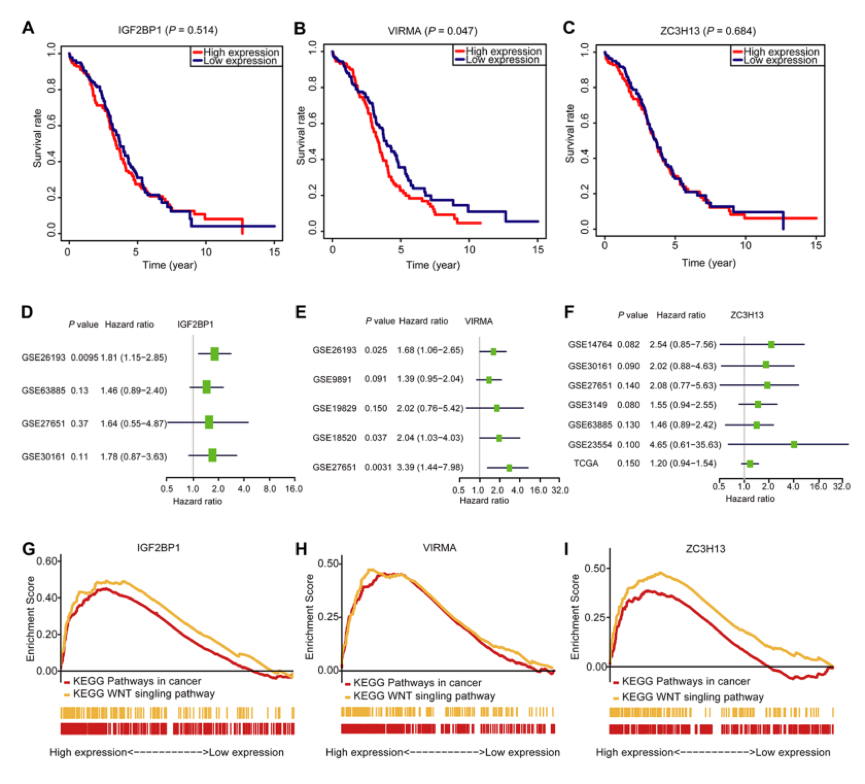
作者从卵巢癌的正常组织和肿瘤组织差异分析出发,得到18个差异表达的m6A RNA甲基化调节因子,基于这18个m6A RNA甲基化调节因子展开单因素cox、LASSO、多因素cox、列线图、生存分析等一系列分析,目的只有一个,就是找出与卵巢癌预后显著相关的m6A RNA甲基化调节因子,可以说文章的思路很明确且分析的也很深入,是一篇值得模仿与借鉴的文章!














