炎症性肠病(IBD)包括克罗恩病(CD)和溃疡性结肠炎(UC),是胃肠道的慢性炎症性疾病。大多数患有这些疾病的患者需要长期药物治疗来诱导和维持缓解。这些治疗可降低复发风险以及皮质类固醇、住院治疗和手术需求。目前,FDA获批的IBD生物和小分子药物包括抗TNF药物(英夫利西单抗、阿达木单抗、戈利木单抗、赛妥珠单抗)、抗整合素治疗(维多珠单抗、那他珠单抗)、抗IL-12/23治疗(乌司奴单抗)、JAK抑制剂(托法替尼)和S1P调节剂(ozanimod)。
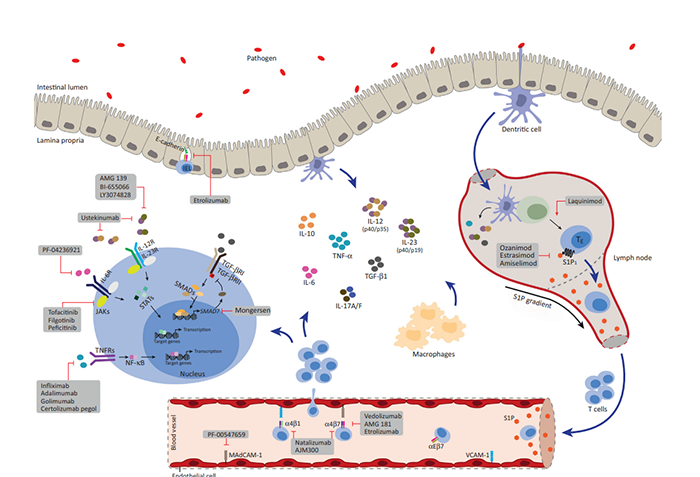
图1.IBD治疗的不同机制
尽管当前治疗方案很多,但许多患者因治疗无应答、无应答或不耐受而需要新的治疗选择。随着具有新型作用机制、更方便给药方式和可能更有利安全性特征的药物的开发,涉及IBD新疗法的研究正在迅速扩展。
IBD的新兴药物疗法目前正处于不同的临床试验阶段(图1)。表1和表2总结了后期临床试验和早期开发中的靶点。
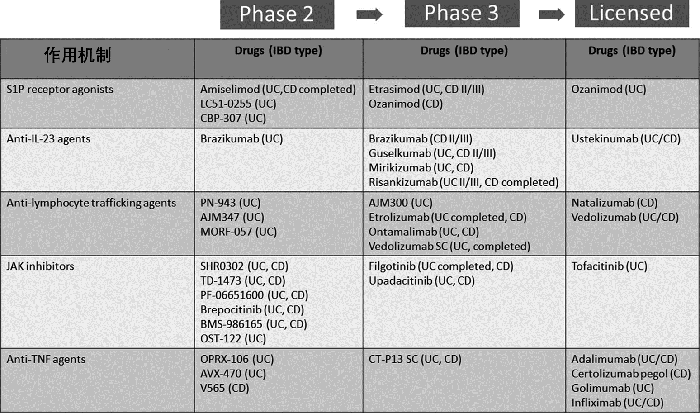
图1:炎症性肠病治疗管线
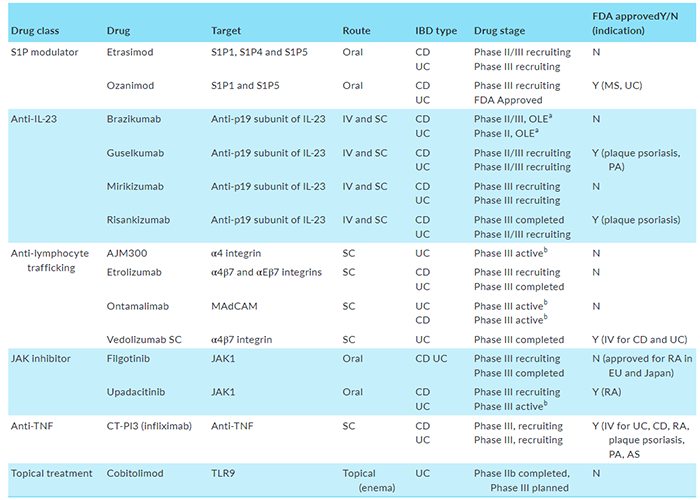
表1. IBD的新药物治疗(2/3期研究)
Etrasimod
Etrasimod是一种口服选择性S1P1、S1P4和S1P5受体调节剂。OASIS ii期研究纳入了156例中重度UC患者(改良Mayo评分[MMS],内镜分项评分[ES]≥2,直肠出血分项评分[RBS]≥1)。接受Etrasimod每日2 mg治疗的患者与基线MMS有显著差异(2.49 vs 1.50,P = 0.009),内镜改善率(41.8%vs 17.8%,P = 0.003)、Mayo总评分改善率(P = 0.010)和Mayo双组分评分改善率(P = 0.002)也较高。最常见的不良事件为UC恶化、上呼吸道感染、鼻咽炎和贫血。研究结束时,分别有64%、33%和43%的受试者获得临床应答、临床缓解或内镜改善。在第12周达到终点的患者中,85%维持临床应答,60%维持临床缓解,60%维持内镜改善。目前,一项UC III期研究和一项CD II/III期研究正在积极招募受试者(NCT03996369、NCT04607837、NCT03950232、NCT04176588和NCT04173273)。
Ozanimod
Ozanimod是一种S1P1和S1P5受体调节剂,美国FDA于2020年批准用于MS,2021年批准用于UC。目前正处于CD的3期临床试验阶段。在3期TRUE-NORTH研究中,18.4%服用ozanimod的患者与6.0%服用安慰剂的患者在第10周达到临床缓解(P < 0.0001)。所有次要终点,包括临床应答(47.8%vs 25.9%,P < 0.0001)、内镜改善(27.3%vs 11.6%,P < 0.0001)和粘膜愈合(12.6%vs 3.7%,P < 0.001)。
在既往接受过抗TNF治疗的患者中,奥扎莫司组和安慰剂组分别有28.9%和10.1%的患者获得临床缓解,55.3%和24.6%的患者获得临床应答(均为P < 0.001)。在诱导治疗研究中,最常见的不良事件为贫血(4.2%vs 5.6%)、鼻咽炎(3.5%vs 1.4%)和头痛(3.3%vs 1.9%)。维持研究中最常见的不良事件为丙氨酸氨基转移酶升高(4.8%vs 0.4%)和头痛(3.5%vs 0.04%)。
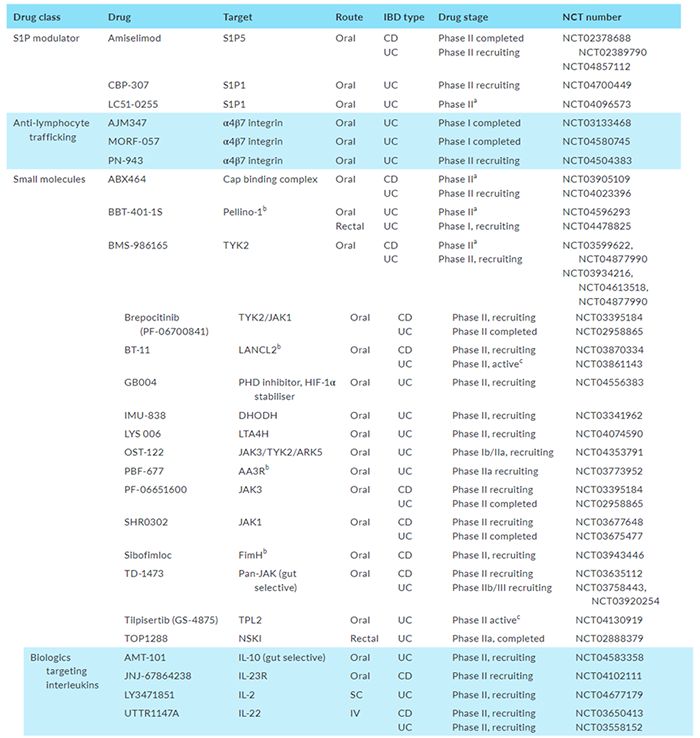
表2.早期开发中IBD的药物治疗
IL-23抑制剂
白细胞介素-23(IL-23)在Th17细胞的分化和成熟中发挥重要作用,Th17细胞可导致肠道炎症和IBD。遗传学研究表明,部分IBD患者IL-23R存在单核苷酸多态性,提示其在疾病易感性中的作用。IL-23有两个组分:p40亚基和p19亚基。p40亚基与白细胞介素-12(IL-12)共享,而p19亚基对IL-23具有特异性。乌司奴单抗是一种抗p40单克隆抗体(mAb),可抑制IL-12和IL-23,目前已获批用于治疗中重度CD和UC。目前,特异性靶向IL-23 p19亚基的mAb正处于临床开发阶段。
Brazikumab
Brazikumab是一种人源化IgG2 mAb,可选择性抑制IL-23。在一项IIa期研究中,119例抗TNF治疗失败的中重度CD患者在第0周和第4周按1:1的比例随机接受brazikumab 700 mg IV或安慰剂。然后,患者有资格在OLE研究中接受brazikumab 210 mg SC每4周一次(至第112周)。主要终点为第8周时的临床应答(CDAI较基线下降100分或临床缓解[CDAI < 150])。与安慰剂组相比,第8周时更多患者获得临床应答(49.2%vs 26.7%,P = 0.01),达到了临床应答和粪便钙卫蛋白或CRP较基线降低50%的复合结局(42.4%vs 10%,P < 0.001)。然而,第8周时的临床缓解无显著差异。第24周时,在初始双盲期间接受安慰剂或brazikumab的患者达到临床应答、临床缓解和复合结局的比例相似。目前,brazikuzmab治疗CD的IIb/III期研究(NCT03759288,NCT03961815)和治疗UC的II期研究(NCT03616821,NCT0427754)。
Guselkumab
Guselkumab是一种抗p19 IgG1 mAb,已获批用于治疗斑块状银屑病。GALAXI是一项II期研究,在250例中重度CD患者中评估了guselkumab。对于所有guselkumab组,第12周时CDAI显著降低(所有组P < 0.001)。此外,所有guselkumab组更多患者达到临床应答、临床生物标记物应答和内镜应答。目前,guselkumab正在进行CD(NCT03466411)和UC(NCT04033445)的IIb/III期研究。此外,还有一项评价guselkumab和戈利木单抗联合治疗中重度UC的IIa期研究(NCT03662542)。
Mirikizumab
Mirikizumab是一种人源化IgG4 mAb,可与IL23的p19亚基结合。ii期试验(I6T-MC-AMAC)纳入了中重度UC患者。第12周时,与安慰剂组的4.5%相比,50 mg组的临床缓解发生率为15.9%(P = 0.66),200 mg组为22.6%(P = 0.004),600 mg组为11.5%(P = 0.142)。mirikizumab 50、200和600 mg组的临床应答率分别为41.3%(P = 0.014)、59.7%(P < 0.001)和49.2%(P = 0.001),而安慰剂组为20.6%。与安慰剂组(6.3%)相比,50 mg组、200 mg组和600 mg组的内镜改善分别为23.8%(P = 0.012)、30.6%(P = 0.0007)和13.1%(P = 0.21)。生物制剂初治患者的临床缓解率、应答率和内镜改善率在数值上更高。第52周时,mirikizumab每4周一次、mirikizumab每12周一次和安慰剂组的临床缓解率分别为46.8%、37.0%和7.7%。
在中重度活动性CD患者的II期研究SERENITY中也评估了Mirirkizumab。第12周时,所有mirikizumab组的内镜应答率均显著高于安慰剂组:200 mg = 25.8%,P = 0.079;600 mg = 37.5%,P = 0.003和1000 mg = 43.8%,P < 0.001,与之相比,安慰剂组患者为10.9%。与安慰剂组相比,接受mirikizumab 600或1000 mg的患者内镜缓解、患者报告结局(PRO2)缓解和CDAI缓解率均更高。目前,计划和/或招募在UC(NCT03518086、NCT03524092、NCT03519945、NCT04004611)和CD(NCT03926130、NCT04232553、NCT04844606)成人和儿童中评估mirikizumab的III期研究。
Risankizumab
Risankizumab是一种靶向p19并抑制IL23的人源化IgG1 mAb。在III期ADVANCE CD研究中,与安慰剂组相比,接受risankizumab 600或1200 mg的患者更有可能通过CDAI(45.2%和41.6%vs 25.2%)或SF/AP(43.5%和41.0%vs 21.7%)和内镜应答(40.3%和32.2%vs 12%)达到临床缓解(均为P < 0.001)。与生物学应答不足的患者相比,既往对生物制剂应答不足的患者具有更高的疗效率。在MOTIVATE中,与安慰剂组相比,接受risankizumab 600 mg或1200 mg的患者也更有可能通过CDAI(42.2%和40.8%vs. 19.3%)或SF/AP(34.6%和39.3%vs. 19.3%)和内镜应答(28.8%和34.1%vs. 11.2%)达到临床缓解。从数值上看,两项研究中安慰剂组的严重AE和严重感染发生率均较高。ADVANCE研究安慰剂组发生2起死亡,MOTIVATE研究risankizumab 1200 mg组发生1起死亡(肺鳞状细胞癌,与研究药物无关)。目前,一项比较risankizumab与乌司奴单抗治疗CD的头对头研究正在进行中(NCT04524611),一项UC的II/III期研究正在招募受试者(NCT03398148)。
抗淋巴细胞转运药物
淋巴细胞表面表达的α4β1和α4β7整联蛋白与内皮细胞表面的粘附分子(血管细胞粘附分子-1[VCAM-1]或粘膜地址素细胞粘附分子-1[MAdCAM-1])之间的相互作用导致促炎性T细胞从血流迁移至胃肠道。这导致慢性炎症见于CD和UC。Natalizumab是一种靶向淋巴细胞表面α4β1和α4β7的α4亚基的人源化IgG4单克隆抗体(mAb),已获批用于CD和MS;但是,它与危及生命的进行性多灶性白质脑病(PML)相关。Vedolizumab是一种靶向α4β7的肠道选择性人源化IgG1 mAb,能够阻止白细胞迁移至肠道,已获批用于治疗UC和CD。
JAK抑制剂
参与CD和UC病理学的细胞因子的许多作用是Janus激酶(JAK)分子激活信号转导蛋白和转录活化因子(STAT)DNA结合蛋白的结果。这种相互作用导致许多炎症蛋白的基因表达。因此,抑制JAK–STAT通路已成为新型IBD治疗的一个有吸引力的靶点。托法替尼是一种口服非选择性JAK抑制剂,于2018年5月被美国FDA批准用于治疗UC。然而,后来的研究显示,与抗TNF药物相比,在至少有1种心血管风险因素接受托法替布5或10 mg BID的50岁以上RA患者中,主要不良心血管事件、恶性肿瘤、静脉血栓栓塞和死亡的风险增加。因此,FDA将托法替布的使用限制在抗TNF治疗失败的UC患者。目前,正在开发用于治疗IBD的选择性更强或肠道特异性JAK抑制剂。
在众多JAK抑制剂中,Upadacitinib毫无疑问是最为抢眼的一款药物。Upadacitinib是一种每日一次、口服的JAK抑制剂,对JAK1的选择性增加。目前,FDA批准其用于治疗中重度RA。在U-ACHIEVE UC研究中,第8周的主要终点显示7.5 mg组、15 mg组、30 mg组和45 mg组分别有8.5%、14.3%、13.5%和19.6%的患者获得临床缓解,而安慰剂组无患者获得临床缓解。
CELEST试验评估了upadacitinib治疗中重度CD患者的情况。第16周时,6 mg组的临床缓解最为明显(27%vs. 11%,P < 0.1)。然而,与未接受安慰剂的患者相比,接受upadacitinib 3、6、12和24 mg每日两次和24 mg每日一次的患者中分别有10%(P < 0.1)、8%(P < 0.1)、8%(P < 0.1)、22%(P < 0.01)和14%(P < 0.05)观察到内镜缓解。第52周时,与安慰剂组相比,12 mg每日两次治疗组的临床缓解率和内镜缓解率最高,但是这些差异没有统计学意义。目前,正在UC(NCT03653026、NCT03006068、NCT02819635)和CD(NCT03345836、NCT03345823、NCT03345849)的III期研究中对upadacitinib进行临床试验。
总结
参考文献:
1.Grossberg LB, Papamichael K, Cheifetz AS. Review: emerging drug therapies in inflammatory bowel disease. Aliment Pharmacol Ther. 2022 Feb 15. doi: 10.1111/apt.16785. Epub ahead of print. PMID: 35166398.














