基于mRNA的治疗方法,在实际应用中较为精准且可用于个体化治疗,因此是现代医学发展的新方向。与哺乳动物细胞系中表达的重组蛋白相比,mRNA的生产更快、更灵活。在过去十年中,mRNA 修饰和递送系统领域的技术发展迅速推进了mRNA疫苗的基础和临床研究。然而,mRNA疗法面临的技术问题也很明显,比如mRNA在溶液和体内的稳定性差,以及mRNA 在体内表达效率低等问题,mRNA疫苗的保护效力并不乐观,这些也是临床应用亟需优化的关键问题。
基于稳定性和蛋白翻译效率而优化开发的mRNA,可以最大限度地提高mRNA生产及避免递送中的损失问题。然而,mRNA 的序列和结构如何影响其在溶液和细胞中的表达和稳定性我们知之甚少。通常认为,虽然具有二级结构的 mRNA有更高的溶液稳定性,但由于二级结构给翻译过程带来难度,因此细胞内蛋白表达量会降低,可这一说法并没有经过试验验证。
在这里,研究人员设计构建了一个mRNA文库,文库中mRNA序列携带各种不同UTRs和CDSs元件,并研究他们对mRNA稳定性和翻译效率的影响。
mRNA 文库的设计
PERSIST-seq 测序
为了寻找稳定高效表达 mRNA 的设计原则,研究者构建了一系列全长mRNA,这些 mRNA含有不同 5' UTR元件、CDS序列和 3' UTR元件,并且开发了一种高通量的RNA 测序技术,PooledEvaluation of mRNA in-solution Stability, and In-cell Stability and TranslationRNA-seq (PERSIST-seq)。该方法可评估mRNA序列在溶液中的稳定性,及其在细胞中稳定性和翻译效率。
该实验中的模板由体外商业合成,每个模板都包含三个特征:(1) 用于IVT 的T7 启动子序列,(2) 3' UTR中 barcode 序列, (3) 3' 端的保守区以便进行PCR和逆转录(RT)反应,由于具有相同的侧翼序列,利用这种设计可以进行高通量扩增和分析鉴定mRNA序列。构建的模板文库,进行体外转录和修饰(3' polyA-tailing 和 5' m7G-capping),然后将 mRNA文库转染到细胞中,并通过barcode测序定量分析(图 1a),从而能够通过多核糖体分析直接测量翻译效率以及细胞或溶液中mRNA的降解。
UTRs序列设计
mRNA文库总共包含233条不同的mRNA序列。其中112条含有不同的5' 和或 3' UTR(图 1a)。这些mRNA序列包含的UTRs有增强或微调mRNA翻译或稳定性的潜力,来源于细胞和病毒基因组的 5' 和 3' UTR 序列。为了测试UTRs变异序列的效果,本研究选择人类血红蛋白亚基 β的 5' 和 3' UTR ( hHBB)作为对照(非hHBB UTR 在这里被称为“UTR变体”),因为它是最有效表达的哺乳动物 mRNA 之一,通常用于研究mRNA翻译和稳定性。为了确保实验交叉可比性,所有的CDS变异序列使用共同的hHBB UTRs。
5' UTR序列来源
1. 来自细胞内高翻译效率的高丰度蛋白质:如核糖体蛋白 (RP)和微管蛋白beta-2B等
2. 5' UTR调节子元件:例如来自 RPL18 的 5' 末端寡嘧啶 (TOP) 基序,它促进 mTOR下游的翻译激活。
3. 翻译增强子:如Hoxa9 P4 RNA 茎环
4. 被报道翻译效率高的 5' UTR:例如补体因子 3 (C3)、细胞色素 P450 2E1 (CYP2E1) 和载脂蛋白 A-II(APOA2)。
3' UTR序列来源
1. 3'UTR序列总共有22条,长度在60-597nt
2. 被报道可以稳定RNA结构:例如类似于表达和核保留元件 (ENE) 的 MALAT1 非编码 RNA 3'-茎环结构和在三螺旋结构中参与富含下游 A的区域
3. 增强蛋白表达的已鉴定序列:例如来自人血红蛋白亚基α1 (HBA1)和细胞色素B-245α链(CYBA)
4. 来自病毒的UTR序列:比如SARAS-Cov-2,登革热病毒,萝卜皱病毒 (TCV)、烟草花叶病毒(TMV) 和烟草蚀刻病毒(TEV)等。
CDSs变异序列设计
本研究中所有的报告基因mRNAs CDS编码区选择Nanolucluciferase ( Nluc)的开放阅读框。为测定CDS序列和结构对mRNA稳定性和翻译效率的影响,研究者将编码靶蛋白的CDS序列和结构的差异最大化。CDS序列变异库的设计方法分为2两种,第1种:无特定的优化参数的前提下,邀请Eterna 实验室对CDS序列优化。第2种,使用优化算法,包括成熟的商业算法:优化密码子适应指数 (CAI)、CureVac9 开发的GC-rich算法、LinearDesign(密码子优化后再进行加权)算法,Ribotree Monte Carlo tree方法等。利用这些方法,共产生121条CDS变异序列。
UTRs和CDSs序列对mRNA翻译效率的影响
为了评估各mRNA的翻译效率,研究者将文库中的233条mRNA转染到HEK293T,然后裂解细胞,并进行蔗糖密度梯度离心,分离得到翻译活跃的mRNA(mRNA上附着多核糖体)和非翻译mRNA(游离mRNA或与40S核糖体亚基结合),再通过barcode区域的RT-PCR进行序列分析。本实验以mRNA分子上附着携带的核糖体量来衡量mRNA的翻译效率,结果发现UTRs序列差异造成每个mRNA分子携带的核糖体量发生高度变化,5' UTR变异组可观测到核糖体载量发生变化的范围最大(图 1d)。这些数据表明5' UTR序列对mRNA翻译效率的影响程度要强于3'UTRs和CDS序列。这些核糖体载量高的mRNA对应的5'UTR序列来源于细胞和病毒。登革热病毒 5' 和3' UTR 均能增加核糖体载量,将两者组合可以起到叠加效应。此外,hHBB 5' UTR 与TEV或 5' TOP 序列元件的融合体也增加了多核糖体载量。更加令人意外的是,与以前的研究报道相反,此文章的研究人员发现高度结构化的 5' UTR,例如登革热病毒 (DEN2),可以有效启动翻译。
为了进一步调查高度结构化的5'UTR对核糖体载量的影响,研究者对SARS-Cov-2基因组RNA结构化的5' UTR进行了系列突变(图 1f),结果发现不管是点突变,替换还是截短均可以提高mRNA核糖体载量,表明可以通过优化结构化5'UTR序列的不同区段来调节mRNA核糖体载量。
在UTR序列保持不改变的情况下,CDS序列变异造成的mRAN核糖体载量的变化范围远小于UTR序列变异带来的变化。对于编码相同蛋白的CDS序列来说,CDS变异序列核糖体载量与序列本身的特性参数:密码子适应指数(CAI)、GC含量、最小自由能(MFE)、信号肽的添加、非同义密码的突变等,没有明显的关联。
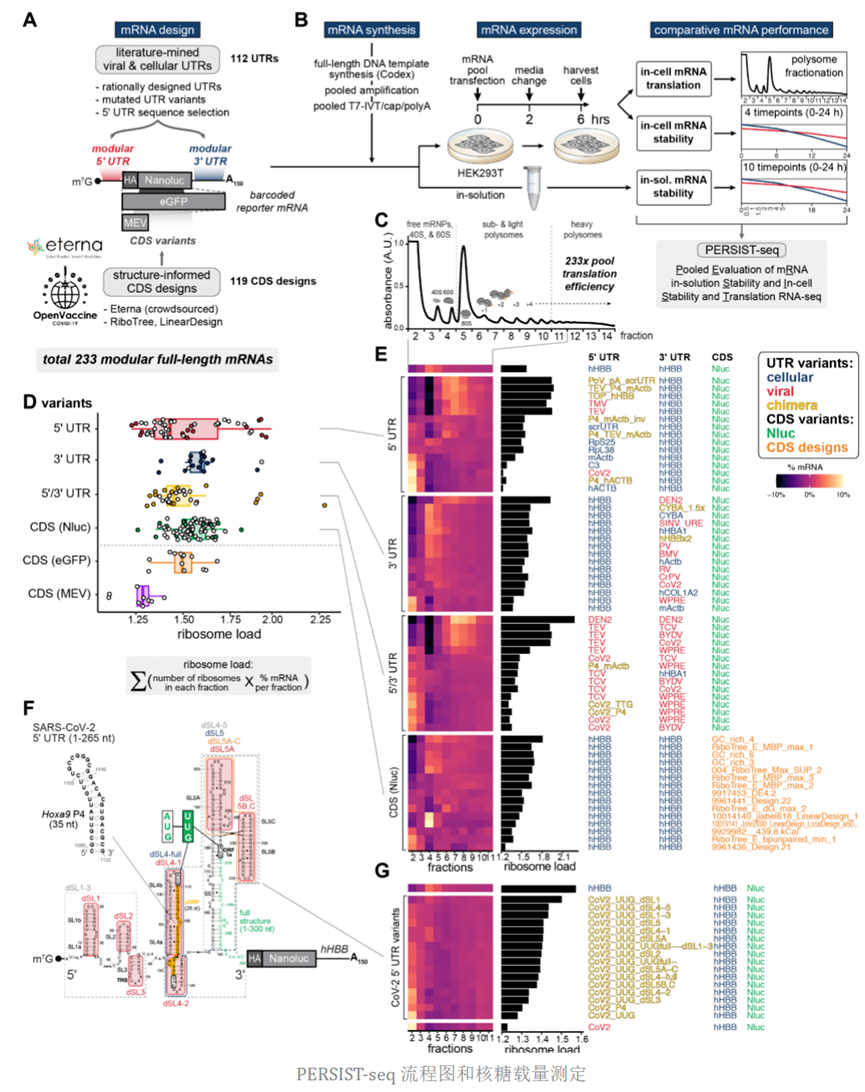
图1 PERSIST-seq流程图和核糖体载量测定
细胞内mRNA稳定性是预测蛋白产量主要考量因素
通过测定文库中233条mRNA在细胞内半衰期,研究者得到了与预期相反的结果即CDS和 5' UTR 序列变化引起细胞内mRNA稳定性发生变化幅度要强于3' UTR序列组成的子库,原本以为3' UTR 序列包含多种顺式调节元件,可以调控细胞mRNA的降解进而影响mRNA稳定。同时,研究人员还注意到核糖体载量与mRNA稳定性之间存在非线性关系,其中核糖体负载的适度增加与mRNA稳定性之间存在正相关,核糖体载量继续增加的mRNA,在细胞内的半衰期越短(图2b)这些发现得出一个意想不到的规则:翻译效率增加,意味着mRNA多核糖体载量多,进而引起 mRNA 稳定性降低,随着时间的推移产生的蛋白质总量实际上变得更低。为了探索核糖体载量和稳定性之间的博弈,研究者将翻译(核糖体载量)和细胞内稳定性整合到一个简单的定量模型中来预测两者对于蛋白产量的影响,结果也证实蛋白总产量和mRNA稳定性呈现相关性。但对于短时间高表达的蛋白或者半衰期高于蛋白的半衰期来说,翻译效率是决定蛋白量的主要预测因素。因此,看转染后早期蛋白的高表达,还是一段时间后的蛋白表达量,根据实验需求的不同,对应的UTR优化的参数可能会有差异。
细胞内mRNA稳定性是预测蛋白产量主要考量因素
研发人员利用PERSIST-seq技术评估mRNA在水溶液中的稳定性。在没有 Mg2+ 或较低 pH 值的条件下,mRNA相对比较稳定。溶液内稳定性的结果与整个mRNA文库的细胞内稳定性结果大不相同。可能由于UTR序列在细胞中通过细胞内翻译机器或者降解机器来调节mRNA稳定性,而在没有这种细胞因子的水溶液中,UTR序列差异对mRNA在水溶液中的稳定性影响相对较小(图 2g)
CDS长度差异是影响mRNA在溶液中稳定性的最大因素,CDS序列越长潜在水解位点的数量越多,mRNA在水溶液中半衰期越短。
mRNA的结构差异也可导致mRNA在溶液中不稳定, CDS序列结构化程度越高,mRNA在水溶液中半衰期越长。
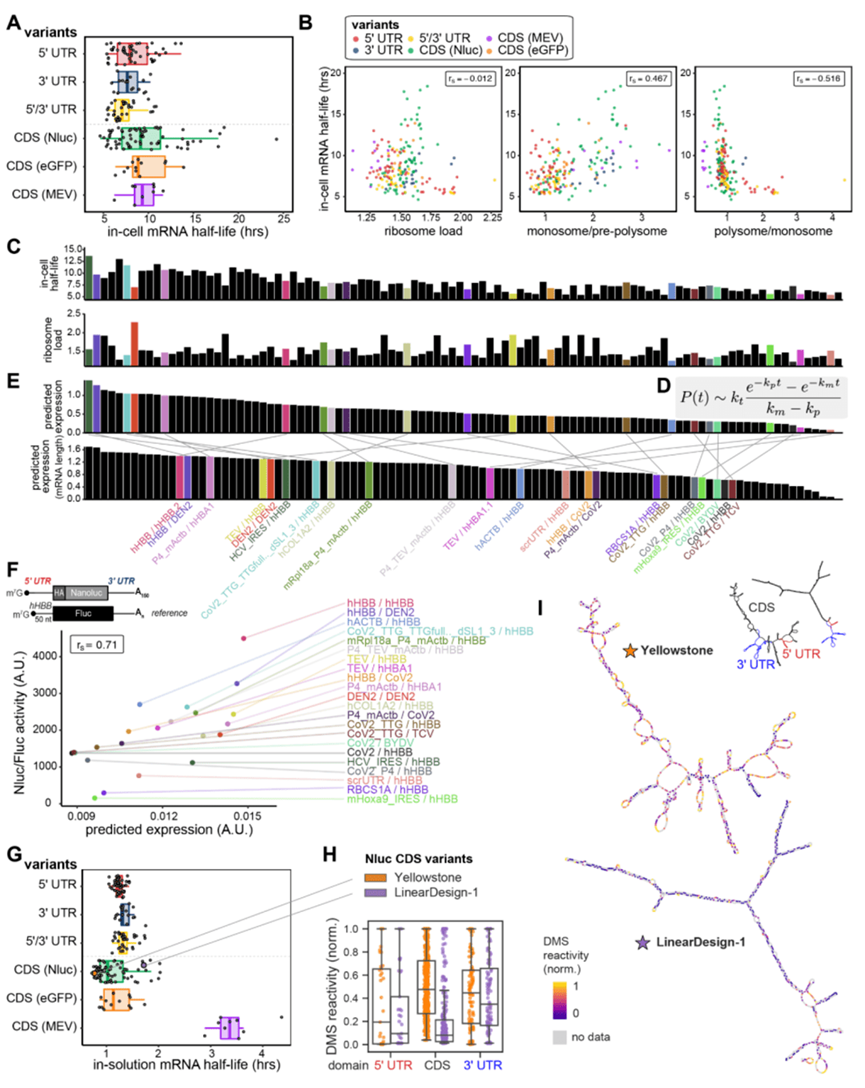 图 2细胞内mRNA稳定性是预测蛋白产量主要考量因素
图 2细胞内mRNA稳定性是预测蛋白产量主要考量因素
假尿苷对溶液中mRNA稳定性的影响
mRNA序列中U被假尿嘧啶,甲基尿嘧啶替代后,可以提高细胞内翻译和稳定性而被广泛应用与mRNA 疗法和疫苗。但这些修饰对溶液中mRNA稳定性的影响尚未见报道。研究人员利用SHAPE 和DMS分析mRNA的结构,发现碱基取代不会改变RNA的总体二级结构,之后利用毛细管电泳检测mRNA在水溶液中随时间变化的稳定性情况,发现 mRNA序列中的尿嘧啶用假尿嘧啶、甲基尿嘧啶替换以后,会抑制mRNA的水解,显著提升其在水溶液中的稳定性,这种抑制效应推测是由于取代位点的局部化学或结构效应引起的(图3)。
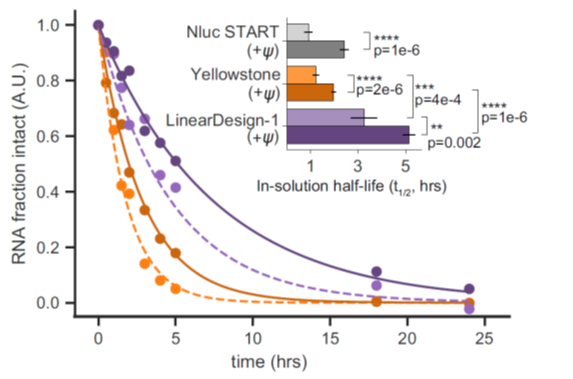 图3 mRNA序列中假尿嘧啶替换可以增加mRNA的稳定性
图3 mRNA序列中假尿嘧啶替换可以增加mRNA的稳定性
叠加mRNA优化策略对稳定性和蛋白产量的影响
本研究前期发现高度结构化的5' 和 3' UTR 可以维持蛋白质的有效合成,并且高度结构化的CDS增加mRNA在水溶液中的稳定性和细胞蛋白质合成。接下来研究人员将选择的UTR 、优化的CDS序列及核苷修饰三者结合探索是否可以实现mRNA的稳定和高效表达,从而达到累加效应?首先考察不同CDS 设计和UTR 结合对mRNA细胞内稳定性和蛋白质表达量的影响。结果显示,LinearDesign-1优化后的CDS序列搭配hHBB UTR序列24h时,蛋白产量与原始参考序列相比,发生显著的增加。当假尿嘧啶替换尿嘧啶后,LinearDesign-1 CDS 搭配hHBB UTR的序列在 6 小时和 24 小时都保持高水平蛋白质表达(图 4)。
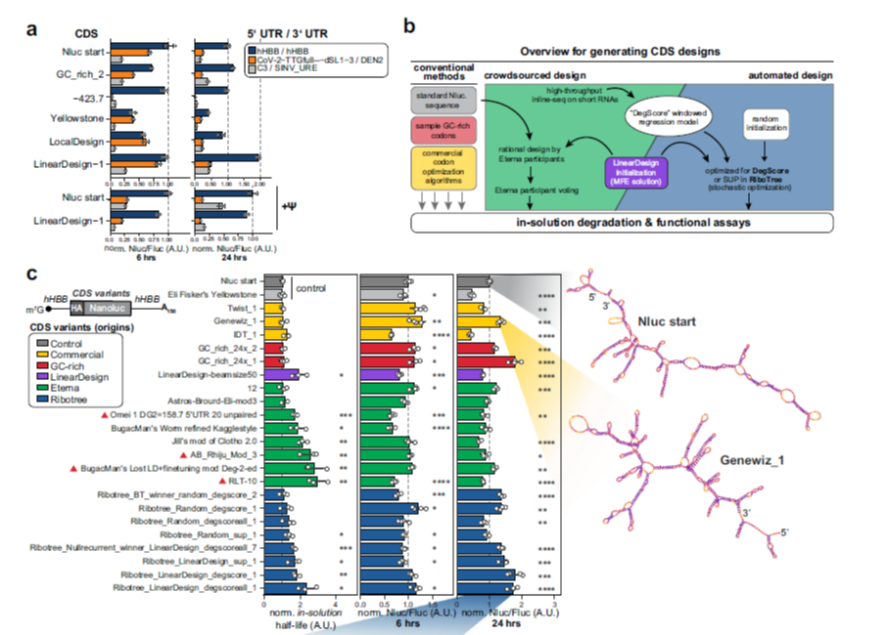
图 4 整合UTR、CDS和核苷酸修饰以提高mRNA稳定性和蛋白表达量
研发人员通过不同的CDS优化算法,构建携带相同UTR序列的mRNA,比较这些mRNA优化序列在溶液中的稳定性和细胞内的蛋白产量,结果发现使用LinearDesign和DegScore引导的RiboTree design组合式CDS优化序列,可以明显提高mRNA稳定性和蛋白产量。此外还测定假尿嘧啶替换对LinearDesign和DegScore引导的RiboTree design组合式CDS优化序列溶液中稳定性和细胞蛋白表达产量的影响。他们首先将原始序列和尿嘧啶替换mRNA序列放置于容易发生降解的溶液中,然后在特定的时间点,纯化回收全部mRNA,转入细胞内,看蛋白表达情况,结果发现用甲基尿嘧啶替换的mRNA序列在溶液中存放2h以后,转入细胞中依然具有表达活性,而不含尿嘧啶未优化的原始序列,在溶液中存放2h后,在细胞中几乎检测不到蛋白表达。
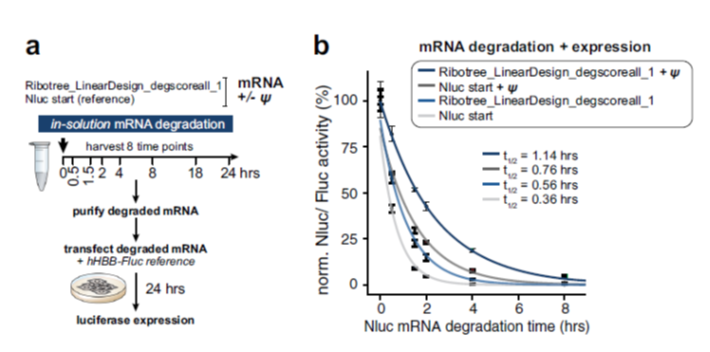
图5 组合式优化mRNA序列中假尿嘧啶替换对mRNA稳定性和蛋白表达产量的影响
总结
基于 mRNA 的疗法在治疗人类疾病方面仍然存在障碍,其重要原因与 mRNA 分子的内在特征有着直接关系。本文从mRNA的组成结构及序列出发,分析了mRNA的UTR序列结构,CDS序列和结构及核苷酸修饰对翻译效率和稳定性的影响。并提供了一个灵活、模块化的计算实验平台,可实现高度结构化mRNA 的全自动设计,为mRNA疗法提供快速解决方案。
文章来源:生物制药小编














