表观遗传学,包括DNA和RNA修饰,一直是后基因组时代生命科学领域的研究热点。其中RNA的化学修饰尤为复杂多样,迄今已鉴定出170多种。
近几年,由于表观转录组学的兴起,RNA的m6A修饰研究超级火爆,仅过去半年时间,相关文章高达929篇!竞争可谓激烈!
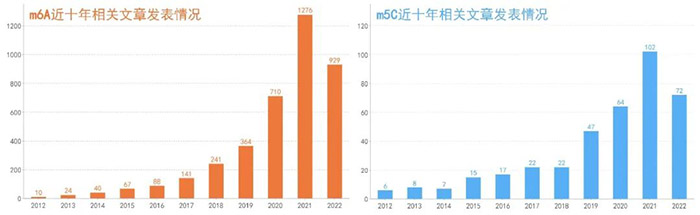
图1 m6A和m5C相关文章发表情况
数据截止2022年7月,源于PubMed
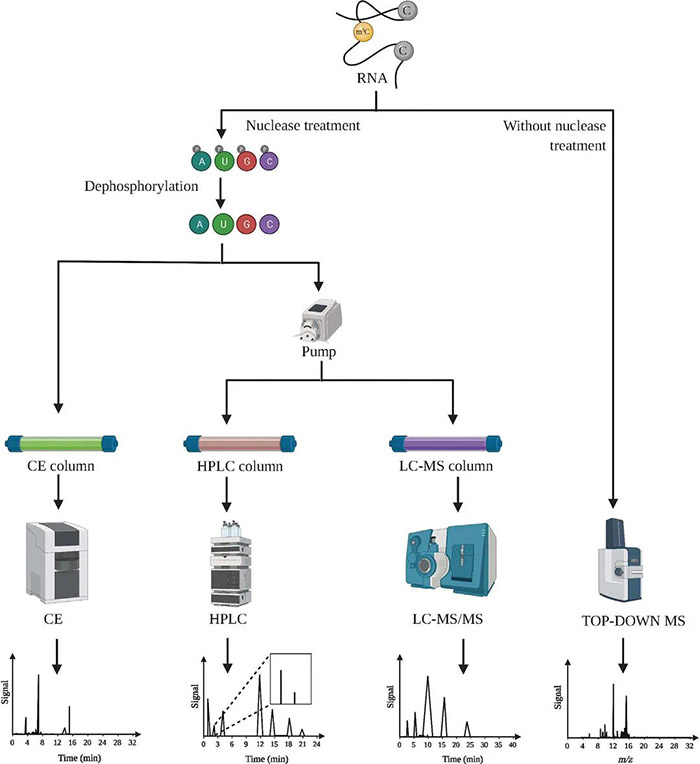
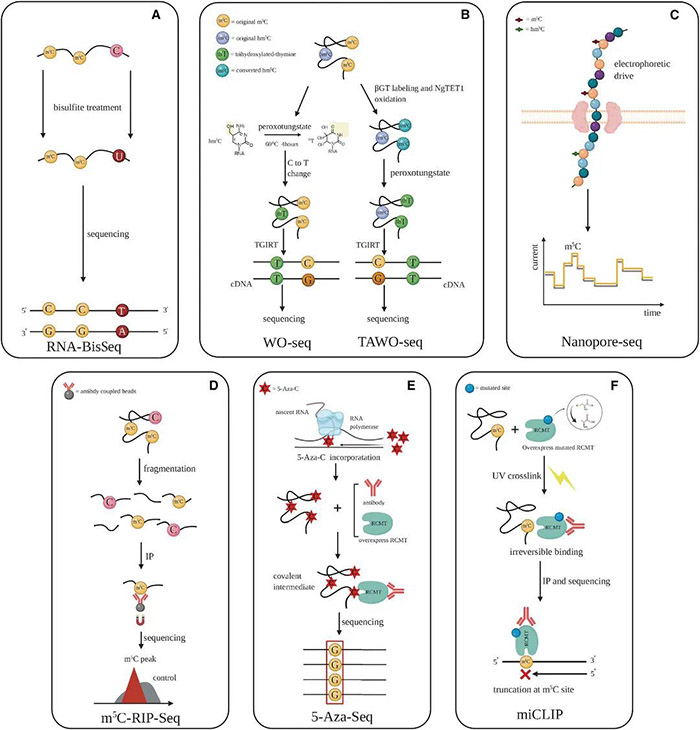
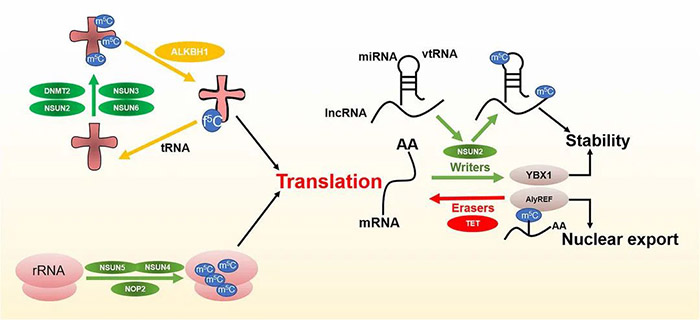
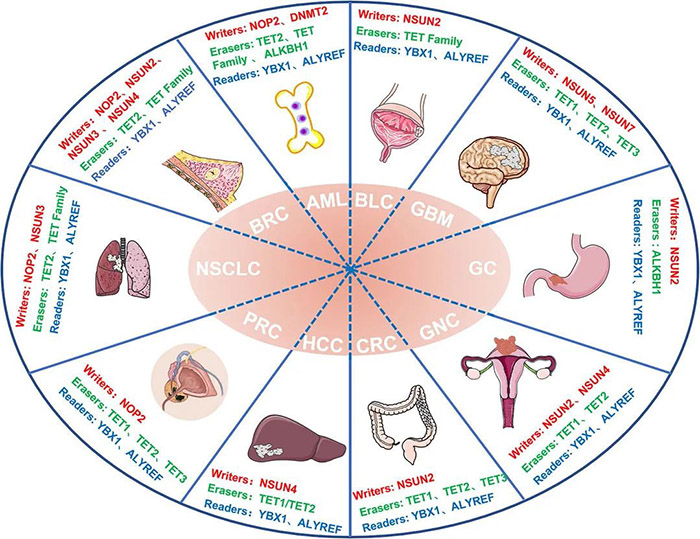
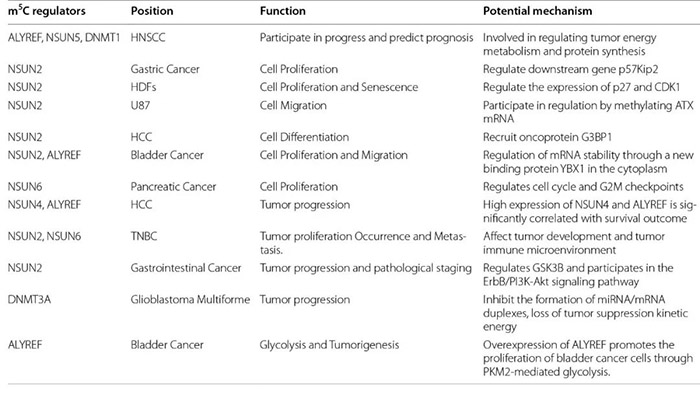
其实在m6A以外,还有另一种广泛存在的转录后调控方式——RNA的m5C甲基化修饰,虽然也引起了不少科学家们的关注,但发文量却仅为m6A的十分之一,一片“蓝海”。 今天,小P就带领大家认识一下m5C这个潜力新星。 1.m5C修饰简介 m5C修饰,即5-甲基胞嘧啶(5-methylcytosine,m5C)修饰,存在于各种生物的mRNA、rRNA和tRNA中。 作为一种动态、可逆且分布较为广泛的表观遗传修饰,m5C修饰影响着许多RNA分子的命运,构成了应对内外部环境不断变化的有效多功能机制。已证实m5C修饰涉及调控细胞稳态、细胞应激、细胞毒性应激、肿瘤发生、肿瘤细胞迁移、胚胎发生,以及病毒复制、植物细胞发育和细菌耐药性等各个方面[1]。 2.m5C修饰对RNA的影响 2.1 m5C修饰对ncRNAs的影响 早期对m5C修饰在RNA中的研究主要集中于tRNA和rRNA上。 在tRNA中,m5C修饰促进碱基配对、控制翻译效率和准确性,调节tRNA稳定性,参与细胞代谢及应激反应[2]。小鼠tRNA-Asp中反密码子环上C38位点的甲基化可以促进含有多个Asp蛋白的翻译,以及保护tRNA免受应激诱导的内切酶介导的切割[3];C48位点的甲基化则可以增强碱基对的疏水性并促进碱基堆叠,以增强蛋白的合成[4]。 图2 m5C在tRNA中的功能 源于[2] 在rRNA中,核糖体功能关键区的m5Cs修饰有助于保持其构象稳定。氧化应激条件下,酵母中的rRNA m5C修饰有助于rRNA折叠,促进mRNA的选择性招募和翻译,以参与不同的细胞信号途径[5]。 还有研究者对lncRNA上m5C的分布和调控进行了研究,结果发现m5C与lncRNA转录呈正相关,它还参与了lncRNA位点的长距离染色质相互作用,并且受不同m5C标记调控的lncRNAs与不同的肿瘤状态有关[6]。 2.2 m5C修饰对mRNA的影响 此前由于mRNA丰度较低,缺乏有效的分离纯化技术,因此研究相对较少。但随着近年来检测方法的进步,对mRNA m5C修饰的研究也逐渐多了起来。 在mRNA中,m5C修饰过程涉及多种酶和效应分子,包括NOP2/SUN RNA甲基转移酶2 (NSUN2)、NSUN6、tRNA天冬氨酸甲基转移酶1(TRDMT1)和Aly/REF输出因子(ALYREF)等[7]。m5C修饰的功能涵盖促进mRNA核质转运、病毒蛋白表达、DNA损伤修复、mRNA稳定、细胞耐受、增殖和迁移、发育、以及mRNA剪接调控等各个方面。 同时,m5C在不同细胞类型中的分布也不同,在mRNA不同特定位置的修饰表现出不同的调控活性,可以促进或抑制翻译[1]。因此,异常的mRNA m5C修饰与多种疾病的发生发展密切相关,包括癌症及多种自身免疫性疾病[8]。 3.m5C修饰的检测手段 作为一种与m6A十分相似的RNA甲基化修饰,二者的鉴定和检测方法也比较雷同。依托于高通量测序技术的发展和液相色谱灵敏度的提高,m5C修饰的主要检测方法包括: 1)物理化学方法,如色谱、质谱(MS)、高效液相色谱(HPLC)和液相色谱-串联质谱(LC-MS); 图3 色谱法和质谱法检测m5C 源自[1] 2)化学转化法,通过结合下一代测序(NGS)技术,如RNA亚硫酸氢盐测序(RNA-BisSeq)和TET辅助的过氧钨酸盐氧化测序(TAWO-seq)等进行检测; 3)免疫沉淀与NGS技术相结合,如m5C单核苷酸分辨率交联与免疫沉淀(miCLIP)和5-氮杂胞苷介导的RNA免疫沉淀测序(5-Aza-seq); 4)基于电信号差异的第三代测序(TGS)(Nanopore-seq); 5)预测模型,如PEA-m5C、m5C-PseDNC、Pm5CS-COMP-mRMR和m5C-heuristic等。 图4 转录组测序法检测m5C 源自[1] 4.m5C修饰相关蛋白 RNA的甲基化修饰主要涉及三种类型的效应器:1)将特定的化学基团“写入”RNA的写入器(Writers),介导RNA的修饰;2)“阅读”这些RNA修饰的信息以维持RNA稳定,并参与核糖核酸翻译和剪接的阅读器(Readers);3)“擦除”RNA修饰,并将其转换为未修饰的核苷的擦除器(Erasers)。m5C甲基化修饰也不例外。 图5 m5C修饰相关的效应子 源自[2] 4.1 m5C写入器 m5C甲基转移酶以腺苷蛋氨酸为甲基供体,通过将甲基转移到胞嘧啶形成m5C。 已发现的RNA m5C甲基转移酶有10多种,包括DNA甲基转移酶2(DNMT2)、tRNA特异性甲基转移酶(TRDMT)家族、NOL1/NOP2/SUN结构域(NSUN)蛋白家族。其中NSUN蛋白家族在人类中有7个成员(NSUN1-NSUN7)。 NSUN2的靶标范围相对比较广泛,在mRNAs、miRNAs和tRNAs的甲基化中发挥主要作用[9]。TRDMT1可催化tRNA中的m5C修饰,但与NSUN2有些许不同,TRDMT1的甲基化只在单个半胱氨酸位点上发生。 除此以外,还有研究表明拟南芥TRM4B也具有甲基转移酶活性,水稻OsNSUN2同样也具有甲基转移酶活性。 4.2 m5C阅读器 m5C修饰后的生物学功能实现,需要特定的识别蛋白识别并结合到修饰位点,引发后续的生物进程调节。目前,对于m5C阅读器的研究还处于早期阶段。 ALYREF是第一个在细胞核中发现的mRNA阅读蛋白,在mRNA的核质输出中起作用;它通过与具有m5C修饰的K171位点(171位点的赖氨酸)特异性地结合,调节mRNA的输出[10];YBX1被鉴定为胞质中的mRNA m5C识别蛋白,通过YBX1冷休克结构域中的残基Trp45识别和结合m5C修饰的mRNA,参与维持m5c修饰mRNA的稳定性[11];此外,RAD52对含有m5C修饰的RNA和DNA的杂交链有更高的亲和力,表明它是DNA损伤位点的m5C读取器,并且RAD52也能通过TRDMT1-m5C-RAD52-RAD51信号链来促进活性氧诱导的DSBs的非典型HR修复。 4.3 m5C擦除器 可逆的甲基化修饰是动态调节的基础,但目前对去甲基化酶(擦除器)的分类及定义还不是十分明确。 早期研究发现了一条与DNA m5C修饰相关的去甲基化途径,TETs作为双加氧酶将m5C氧化成5caC(5-羧基胱氨酸),然后被胸腺嘧啶-DNA糖基化酶切割,从而完成DNA的去甲基化修饰。 Fu等人在RNA上也发现类似的进程:TETs在α-酮戊二酸及铁离子的协同下催化m5C转化为hm5C,hm5C进一步被TETs转化为5fC(5-氟胞嘧啶)和5caC,最后通过碱基切除修复途径将该位点转化为胞嘧啶,完成去甲基化[12]。 此外还有另一个DNA/RNA双加氧酶ALKBH1也被发现参与了tRNA的去甲基化[13],并且ALKBH1的缺失导致线粒体翻译和耗氧量的严重不足,表明m5C可能在调节线粒体活性方面具有巨大的潜力[14]。 5.m5C修饰与癌症 近年来的研究发现,RNA的m5C甲基化修饰与多种疾病相关,尤其是肿瘤类疾病。 图6 m5C修饰异常与癌症 源自[2] Zhang等人发现肝癌组织中mRNA m5C甲基化程度明显高于癌旁正常组织,不同部位基因分布有显著差异[15];He等人也表示NSUN4和ALYREF的高表达与肝细胞癌患者预后不良相关,虽然具体的潜在机制尚不清楚[16]。 Mei等人报道NSUN2在胃癌组织中的表达也明显高于癌旁的正常组织,并可能通过抑制p57Kip2的表达以m5C依赖的方式促进胃癌细胞的增殖[17]。Chen等人证明YBX1可以识别m5c修饰的mRNA,并招募ELAVL1来稳定HDGF mRNA,最终促进膀胱癌细胞的增殖和转移[18]。 还有研究显示,m5C修饰水平低的甲状腺乳头状癌(PTC)患者静息状态下的CD4+记忆性T细胞和CD8+T细胞较高,预后较好;而m5C修饰水平低的PTC患者中,活化的NK细胞和单核细胞大多较丰富,预后较差[19]。 图7 m5C修饰异常与癌症 源自[2] 以上案例,都是m5C参与癌症的一些证据和线索,m5C修饰和它的效应物,如NSUN2和YBX1等,可能将为疾病治疗提供新的靶点和方向,在癌症的诊断、治疗和预后上提供帮助。 6.m5C修饰研究展望 总体而言,m5C作为众多RNA修饰中的一种,已经渐渐引起了人们的关注。部分先行的科学家们,在该方向上取得了一些成果:发现了十数种m5C修饰相关蛋白,揭示了m5C修饰对mRNA和非编码RNA的影响,同时也探索了m5C修饰在疾病尤其是癌症中的作用。 但相较于m6A而言,m5C修饰相关研究才刚刚起步。基于二者已有的研究成果对比,未来m5C相关研究可能会在以下方面形成突破: 1)更多m5C修饰的写入器、阅读器、擦出器揭示。某些m5C位点在NSUN2基因敲除或敲除细胞系中仍然能够保持高甲基化水平,并且这些m5C位点与依赖于NSUN2的m5C位点具有不同的序列和结构特征,这表明存在未知的甲基转移酶参与了m5C位点的催化作用。 2)m5C与m6A等修饰之间的相互作用。在氧化应激诱导的细胞衰老过程中,NSUN2介导的m5C和由METTL3/METTL14介导的m6A在翻译水平上相互促进并协同增强p21的表达,证明了不同修饰之间互作的可能性。 3)m5C修饰调控癌症进程的详细分子机制。很多已有证据表明m5C修饰或m5C修饰相关蛋白参与到肿瘤发生的各个阶段中,但是m5C在其中是否占据主导作用,以及其调控的详细通路都有待进一步挖掘。 4)m5C修饰在非肿瘤性疾病中的作用。目前针对m5C与疾病相关的研究,绝大部分都集中在肿瘤上,非肿瘤性疾病很少,因此在未来的研究中拓宽m5C修饰相关疾病类型,也是一个不错的探索方向。 5)m5C和相关蛋白作为疾病诊断/治疗靶点。上面提到部分癌症中,m5C修饰水平和NSUN2等蛋白水平在不同部位、不同人群中的分布呈现一定的规律,这也暗示了m5C和相关蛋白可能会成为疾病诊断和治疗的新靶点,通过靶点的情况给疾病和患者分型,通过靶点的抑制剂或激活剂干扰疾病的进程。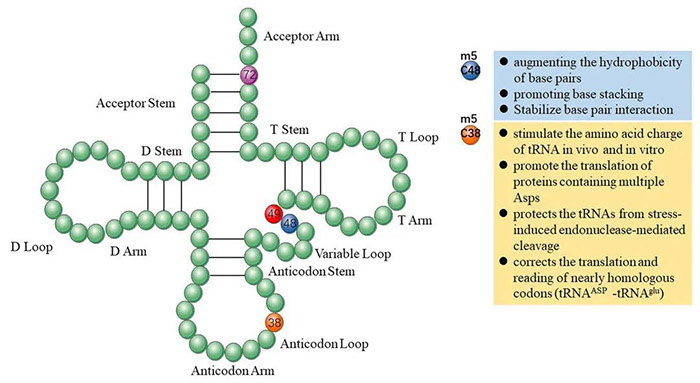
— — END — —
参考文献(下滑查看更多) 1.Guo G, Pan K, Fang S, Ye L, Tong X, Wang Z, Xue X, Zhang H. Advances in mRNA 5-methylcytosine modifications: Detection, effectors, biological functions, and clinical relevance. Mol Ther Nucleic Acids. 2021 Aug 26;26:575-593. 2.Song H, Zhang J, Liu B, Xu J, Cai B, Yang H, Straube J, Yu X, Ma T. Biological roles of RNA m5C modification and its implications in Cancer immunotherapy. Biomark Res. 2022 Apr 1;10(1):15. 3.Goll MG, Kirpekar F, Maggert KA, Yoder JA, Hsieh CL, Zhang X, Golic KG, Jacobsen SE, Bestor TH. Methylation of tRNAAsp by the DNA methyltransferase homolog Dnmt2. Science. 2006 Jan 20;311(5759):395-8. 4.Xu L, Liu X, Sheng N, Oo KS, Liang J, Chionh YH, Xu J, Ye F, Gao YG, Dedon PC, Fu XY. Three distinct 3-methylcytidine (m3C) methyltransferases modify tRNA and mRNA in mice and humans. J Biol Chem. 2017 Sep 1;292(35):14695-14703. 5.Sharma S, Yang J, Watzinger P, Kötter P, Entian KD. Yeast Nop2 and Rcm1 methylate C2870 and C2278 of the 25S rRNA, respectively. Nucleic Acids Res. 2013 Oct;41(19):9062-76. 6.Hu H, Shu M, He L, Yu X, Liu X, Lu Y, Chen Y, Miao X, Chen X. Epigenomic landscape of 5-hydroxymethylcytosine reveals its transcriptional regulation of lncRNAs in colorectal cancer. Br J Cancer. 2017 Feb 28;116(5):658-668. 7.Yang X, Yang Y, Sun BF, Chen YS, Xu JW, Lai WY, Li A, Wang X, Bhattarai DP, Xiao W, Sun HY, Zhu Q, Ma HL, Adhikari S, Sun M, Hao YJ, Zhang B, Huang CM, Huang N, Jiang GB, Zhao YL, Wang HL, Sun YP, Yang YG. 5-methylcytosine promotes mRNA export - NSUN2 as the methyltransferase and ALYREF as an m5C reader. Cell Res. 2017 May;27(5):606-625. 8.Luo Y, Feng J, Xu Q, Wang W, Wang X. NSun2 Deficiency Protects Endothelium From Inflammation via mRNA Methylation of ICAM-1. Circ Res. 2016 Mar 18;118(6):944-56. 9.Khoddami, V. and Cairns, B.R. (2014) Transcriptome-Wide Target Profil-ing of RNA Cytosine Methyltransferases Using the Mechanism-Based Enrichment Procedure Aza-IP. Nature Protocols, 9, 337-361. 10.Li W, Xu L. Epigenetic Function of TET Family, 5-Methylcytosine, and 5-Hydroxymethylcytosine in Hematologic Malignancies. Oncol Res Treat. 2019;42(6):309-318. 11.Takai, H., Masuda, K., Sato, T., et al. (2014) 5-Hydroxymethylcytosine Plays a Critical Role in Glioblastomagenesis by Recruiting the CHTOP-Methylosome Com-plex. Cell Reports, 9, 48-60. 12.Tuorto F, Herbst F, Alerasool N, Bender S, Popp O, Federico G, Reitter S, Liebers R, Stoecklin G, Gröne HJ, Dittmar G, Glimm H, Lyko F. The tRNA methyltransferase Dnmt2 is required for accurate polypeptide synthesis during haematopoiesis. EMBO J. 2015 Sep 14;34(18):2350-62. 13.Haag S, Sloan KE, Ranjan N, et 0al. NSUN3 and ABH1 modify the wobble position of mt-tRNAMet to expand codon recognition in mitochondrial translation. EMBO J. 2016;35(19):2104–19 14.Ougland R, Jonson I, Moen MN, Nesse G, Asker G, Klungland A, Larsen E. Role of ALKBH1 in the Core Transcriptional Network of Embryonic Stem Cells. Cell Physiol Biochem. 2016;38(1):173-84. 15.Zhang Q, Zheng Q, Yu X, He Y, Guo W. Overview of distinct 5-methylcytosine profiles of messenger RNA in human hepatocellular carcinoma and paired adjacent non-tumor tissues. J Transl Med. 2020 Jun 22;18(1):245. 16.He Y, Yu X, Li J, Zhang Q, Zheng Q, Guo W. Role of m5C-related regulatory genes in the diagnosis and prognosis of hepatocellular carcinoma. Am J Transl Res. 2020 Mar 15;12(3):912-922. 17.Mei L, Shen C, Miao R, Wang JZ, Cao MD, Zhang YS, Shi LH, Zhao GH, Wang MH, Wu LS, Wei JF. RNA methyltransferase NSUN2 promotes gastric cancer cell proliferation by repressing p57Kip2 by an m5C-dependent manner. Cell Death Dis. 2020 Apr 24;11(4):270. 18.Chen X, Li A, Sun BF, Yang Y, Han YN, Yuan X, Chen RX, Wei WS, Liu Y, Gao CC, Chen YS, Zhang M, Ma XD, Liu ZW, Luo JH, Lyu C, Wang HL, Ma J, Zhao YL, Zhou FJ, Huang Y, Xie D, Yang YG. 5-methylcytosine promotes pathogenesis of bladder cancer through stabilizing mRNAs. Nat Cell Biol. 2019 Aug;21(8):978-990. 19.Li F, Deng Q, Pang X, et al. M (5) C regulator-mediated methylation modifcation patterns and tumor microenvironment infltration characterization in papillary thyroid carcinoma. Front Oncol. 2021;11:729887














