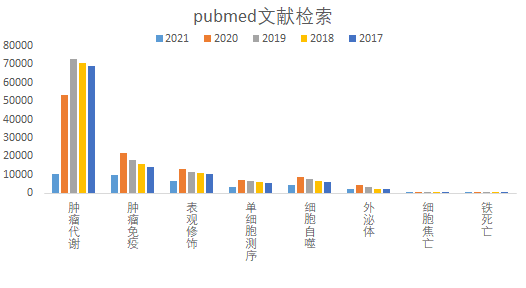
综合近年来国家自然科学基金的中标项目名称以及对近几年pubmed中发表的文献论文题目检索结果分析后发现,目前基础临床科研领域的研究具有一定的热度趋势,如在肿瘤代谢、肿瘤免疫、表观修饰、细胞自噬、单细胞测序、外泌体、细胞焦亡、铁死亡等方向的研究具有较高的研究热度(如图1),此8个研究热点引起了广大基础临床科研工作者的广泛关注,因此小编准备了2期文章简要阐述这几大研究热点的研究背景和常用的技术手段,有助于快速了解前沿热点,及时将现有研究内容与之连接,快速深入探究疾病的发病机制。
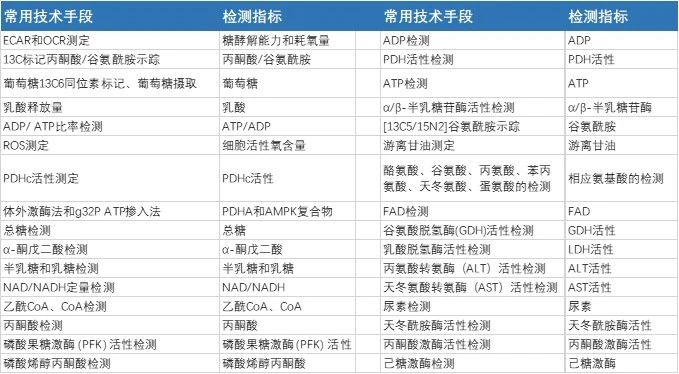
研究背景 肿瘤细胞具有无限增殖的特征,为了满足其快速增殖需要,肿瘤细胞会表现出与正常细胞不同的代谢特征,即肿瘤细胞代谢异质性。肿瘤代谢异常已被列为肿瘤的十大特征之一。肿瘤细胞能够进行代谢重编程(与它同系的正常细胞代谢模式不同,称这种代谢的改变为代谢重编程),主要特征有:糖酵解(葡萄糖代谢异常是肿瘤细胞代谢最突出的特点)、谷氨酰胺分解(谷氨酰胺作为肿瘤生长的必需氨基酸,为肿瘤细胞提供氮源和碳源,用于支持肿瘤细胞的生物合成、能量代谢和细胞内稳态)、脂质代谢(肿瘤细胞脂类代谢异常主要表现为不受控制的脂肪酸从头合成和其他脂类合成增强)、磷酸戊糖途径PPP及其他生物合成和生物能量途径的上调,对肿瘤的快速增殖、发生、发展、转移等起着非常重要的作用。对肿瘤代谢途径的研究已成为近年来研究的一大热点。 此外,在肿瘤中和代谢相关的代谢基因多出现不同程度的突变,如:编码三羧酸循环中的关键酶的几个突变基因:FH(珀酸脱氢酶下游的延胡索酸水化酶编码基因),SDH-A/B/C/D(编码琥珀酸脱氢酶中的亚基),SDHAF2(辅助这些亚基组装的基因),IDH1和 IDH2(编码异柠檬酸脱氢酶)。这些基因的突变最终抑制了α-酮戊二酸(α-KG)依赖的双加氧酶活性,从而调控信号通路、表观遗传修饰、促进DNA与组蛋白的去甲基化等过程。 相关实验技术 针对肿瘤代谢的研究技术有很多,目前比较前沿、TOP文章必不可少的当属代谢组学、蛋白组学以及糖脂质谱分析,通过高通量筛选获得差异代谢物。此外,可以通过相关试剂盒检测各种代谢物的含量,如下图展示的是针对不同代谢产物所对应的检测手段: 研究背景 机体的免疫系统通过多种途径消除肿瘤细胞或抑制其增长,其具体过程如下:1、肿瘤抗原释放;2、肿瘤抗原呈递;3、启动和激活效应性T细胞;4、T细胞向肿瘤组织迁移;5、肿瘤组织T细胞浸润;6、T细胞识别肿瘤细胞;7、清除肿瘤细胞,这些环节任何地方出现异常均可导致抗肿瘤免疫循环的失效。在免疫细胞和肿瘤细胞“battle”过程中,肿瘤细胞也在“拼命抵抗和伪装”,通过自身的改变想方设法不生成有效的抗原,又比如可以释放一些干扰免疫细胞的物质以适应机体的免疫监视,从而逃脱免疫系统的监视和抑制免疫细胞的杀伤效果,从而出现免疫逃逸和免疫抑制。 免疫逃逸(immune escape):如肿瘤细胞让其表明的MHCⅠ类分子低表达,从而肿瘤细胞提呈抗原的能力变弱,无法诱导CTL(细胞毒性T淋巴细胞)的活化和杀伤肿瘤细胞;某些肿瘤细胞高表达非经典的人类白细胞抗原I类分子如HLA-E、HLA-G等,也是逃逸免疫的机制之一;PD-1(程序性细胞死亡蛋白1,programmed cell death protein1)的过表达与CD8+ T细胞功能障碍有关,有助于肿瘤免疫逃逸;肿瘤细胞高表达多种抗凋亡分子(如Bcl-2),弱或者不表达Fas等凋亡诱导分子,从而抵抗CTL等诱导的凋亡,逃避杀伤效应。 免疫抑制(Immunosuppression):如医药市场近几年的研究火热治疗靶点PD-L1。肿瘤细胞表面高表达的PD-L1和免疫细胞上的PD1接触之后,会抑制效应免疫细胞的激活。因此它的高表达往往可以作为一种检测标志物。又如细胞表面的CD73可以促进ATP形成腺苷(Adenosine),腺苷会抑制效应免疫细胞,促进MDSCs、Treg等;另一方面ATP的缺少又可以使DC激活受到抑制,双面抑制了免疫反应。癌细胞还会产生一些具有抑制功能的代谢物和细胞因子,比如lactate, IL-10, TGFb1等;肿瘤细胞很少表达CD80和CD86等正性共刺激分子,因而不能为T细胞活化提供有效的第二信号,也就无法有效诱导抗肿瘤免疫应答,产生免疫耐受;另外,聪明的肿瘤细胞还能够通过主动诱导机体产生Treg和MDSC抑制机体的免疫应答反应。 相关实验技术 单细胞RNA-Seq:可以用于研究实现肿瘤免疫细胞的分群,辅助分析和解答组织的免疫细胞异质性问题。 免疫细胞的分群:流式细胞术分离得到T cell 、B cell 、NK cell 、T-reg cell、Neutrophils、DC cell等,进行肿瘤免疫细胞功能学的检测。 CAR-T :通过基因工程技术将T细胞激活,并装上定位导航装置CAR(嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”即CAR-T细胞专门识别体内肿瘤细胞,高效杀灭肿瘤细胞从而达到治疗恶性肿瘤的目的。 细胞免疫测定法:淋巴细胞分离技术、淋巴细胞转化试验、巨噬细胞抑制试验、玫瑰花结形成试验(包括E 玫瑰花结试验)、吞噬试验、四唑氮蓝试验、嗜碱粒细胞脱粒试验、淋巴细胞毒性试验以及组织定型试验和组织配型试验等,用以检测细胞免疫能力。 研究背景 表观遗传是指基因的DNA序列没有发生改变而基因功能发生了变化,并引起表型改变的一种可遗传现象。表观遗传所涉及到的调控机制主要是:DNA、RNA和组蛋白三个水平的修饰。DNA层面存在的修饰类型主要有甲基化、去甲基化和磷酸化;RNA层面上存在的修饰类型主要有:m6A甲基化、ac4c乙酰化;蛋白层面存在的修饰类型主要有:甲基化、乙酰化、磷酸化、泛素化等等。而目前超级增强子、m6A甲基化和ac4c乙酰化这三个方向是近年来研究比较火热的方向。 超级增强子 超级增强子 (Super Enhancer, SE): 是指一大簇相邻的增强子,具有转录增强活性的超长顺式作用元件,富集高密度的关键转录因子、辅因子和增强子,能够驱动控制细胞身份基因的表达,用来解释细胞类型特异的表达模式,在发育生物学、癌症等疾病致病机理研究中具有巨大的应用潜力。 超强增强子相关实验技术 ChIP-seq:针对增强子相关转录因子及其辅因子(如 Mediator、BRD4)或组蛋白修饰(如H3K27ac、H3K4me1)进行 ChIP-seq,最常用的是H3K27ac的CHIP,然后使用“ROSE”算法分析和鉴定超级增强子。 ATAC-seq:鉴定了基因组范围内所有的开放区域,这些开放区域一般都有转录因子结合,将 ATAC-seq Peak 数据与 SE 数据取交集,排除部分处于关闭转态的 SE,提高TF 预测的准确性 。 STARR-seq:一种高通量分析鉴定具有增强子功能的 DNA 序列的方法。 双荧光素酶报告基因实验:即luciferase实验验证 SE 对靶基因的转录调控活性。 m6A甲基化 m6A甲基化:mRNA中有许多修饰,包含了m5c、m1a、ac4c、m6A等,其中m6A是mRNA上丰度最高的一种,目前也是研究较多的一种。m6A修饰在基因表达调控中起着重要的作用,如在转录后水平上调控RNA的稳定性、定位、运输、剪切和翻译等。目前已发现m6A参与了肿瘤生成或转移、免疫、干细胞更新、脂肪分化、细胞发育分化等一系列病理生理过程。 m6A甲基化相关实验技术 meRIP-seq:m6A 特异性抗体对细胞内具有 m6A 修饰的 RNA 片段进行免疫共沉淀,将富集下来的 RNA 片段进行高通量测序,即可在转录组范围内对m6A 修饰进行系统研究。 RIP-seq:使用特异蛋白抗体对 RNA 结合蛋白或者特殊修饰的 RNA 进行免疫共沉淀后,分离RNA通过二代测序,在全转录组范围内研究被特定蛋白特异结合的RNA区域。 Ribo-seq:过对细胞使用翻译抑制剂,使正在翻译的核糖体固定在 mRNA 序列或者起始位点上。裂解细胞后在细胞裂解液中加入 RNase,消化不受核糖体保护的 mRNA,分离单一核糖体并提取纯化核糖体上未被消化的短片段 mRNA,进行建库测序和相应的数据分析。 ac4C RNA乙酰化 ac4C RNA乙酰化:在RNA ac4C修饰酶的作用下,使N4位乙酰胞嘧啶发生乙酰化的一种保守的化学修饰(N4-acetylcytidine)。前期研究发现该修饰存在于真核生物中丝氨酸及亮氨酸tRNA和18S rRNA上,导致Watson-Crick碱基热稳定性增加,调控蛋白合成中的编码准确性。近期研究发现ac4C分布在人类转录组中,大多数位点出现在编码序列(CDS)内,并且通过改善的mRNA稳定性和翻译促进靶基因表达。 ac4C RNA乙酰化相关实验技术 acRIP-seq是目前研究此修饰比较常用的方法,大概原理是将乙酰化 RNA 特异性抗体与被随机打断的RNA片段进行共孵育,抓取有乙酰化修饰的片段进行测序,将 RNA乙酰化修饰位点定位到转录组上,并结合RNA-seq 数据从而计算样本中RNA乙酰化程度及其对RNA表达水平的影响。 研究背景 细胞是生命的基本单元,单细胞测序的对象是单个细胞内的DNA或RNA。传统的研究方法是在多个细胞水平进行的,最终得到的信号值是多个细胞的平均值,而每个细胞并不是完全一样的,丢失了组织“异质性”的信息。而单细胞测序能够将样本组织块消化分离出单个细胞,对单个细胞进行基因表达分析,从而使研究更加精细,目标指向更加明确,检测出混杂样品中无法得到的异质性的关键信息,此信息对于疾病发病机理的解释至关重要。 针对单细胞测序技术,过去的十多年时间里主要解决了两大技术问题(单和少),即细胞单个的问题、单个细胞遗传物数量少的问题,单细胞测序技术则解决了这两个难题,从而必将迎来此研究领域的应用大爆发。 单细胞RNA测序要解决的主要问题 目标细胞一共分多少群,每个群对应哪种细胞? 如何定义新的细胞类群,已知的某类细胞是否可分成几个亚群? 每个细胞群/亚群的marker基因? 不同样本(病人)间的细胞构成有何差异? 细胞构成和基因表达差异与表型的关系? 单细胞RNA测序应用场景 药物处理细胞后的细胞分化情况,不同细胞类群的致病能力如何? 某些肿瘤细胞系成瘤能力为什么不稳定,哪些细胞影响成瘤能力? 药物剂量效应在单细胞群体上的反映如何? 不同基因操作后的表型如何?影响组织细胞类群如何变化? 对于不直接杀伤细胞的药物,其治疗效果是否可以通过单细胞类群的区分来体现? 临床多种药物可以使用,什么药物对什么类群的细胞最有效?联用的药物分别针对的细胞类群是什么? 相关实验技术(单细胞的分离) 获得高质量的单细胞测序数据离不开单细胞样本的制备,单细胞分离的平台主要有基于 microwell 的微孔板芯片泊松分布实现单个细胞的分离和基于微流控 Droplet 技术分离单个的细胞。 BD-Mircowell 技术:大概原理是20 万个微孔的尺寸被设计成一个微孔恰好可以容纳一个 bead(磁珠),bead 上连接逆转录引物,引物主要包括以下几个部分 : 1. CL(cell label, 细胞标签); 2. UMI(unique molecular identifier); 3. poly dT,和 mRNA 3' 端 poly A 互补配对。同时悬液被稀释到适当浓度,微孔随机捕获单细胞,单细胞捕获率为 80%。 10X - Droplet 技术:使用 GemCode 技术,通过控制微流体的进入,将带有 barcode、UMI、引物及酶的凝胶珠(Gel Beads)与单细胞混合,从而实现大规模的单细胞分离,以及单细胞文库的构建。