不良事件(adverse event, AE)是指受试者在临床试验过程出现的不良医学事件。不良事件不一定与试验处理因素间有因果关系。对于不良事件,临床试验统计报告中使用的一般是治疗期间出现的不良事件(treatment emergent adverse event,TEAE),ICH指南E9《临床试验的统计学指导原则》对其的定义是在治疗过程中出现的,而在治疗前并未出现或相对于治疗前发生恶化的不良事件。
严重不良事件(serious adverse event, SAE)是指临床试验过程中发生需住院治疗、延长住院时间、致伤致残、影响工作能力、危及生命或死亡、导致先天畸形、死亡等事件。不同研究中对严重不良事件的定义是不同的,因此,每个临床试验中的SAE需给出具体的定义,并在方案中阐明。
不良反应和严重不良反应是指临床试验中的受试者出现的与试验药物、处理有关的不良事件或者严重不良事件。不良事件和不良反应的主要区别在于因果关系是否确定。副作用(side effect,SE)是属于不良反应的一种,其和药物的因果关系是确定的,是指药品按正常剂量服用时所出现的与药品的药理学活性相关,但与用药目的无关的作用。除副作用外,药品不良反应还包括毒性作用、后遗效应、变态反应等。
不良事件与药物关系的判断有多种方法,但并没有一个金标准。如为规范药品上市后个例不良反应的收集和报告而颁布的《个例药品不良反应收集和报告指导原则》(2018年第131号)将关联性评价分为肯定、很可能、可能、可能无关、待评价和无法评价6级,详见表1。
表1 不良事件与药物关系的判定标准
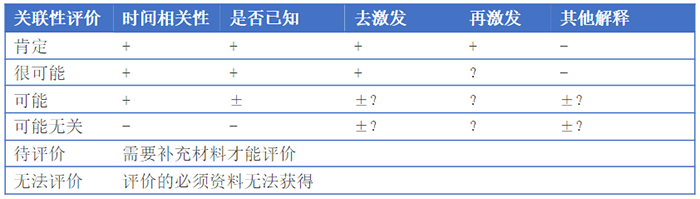
① +表示肯定或阳性;-表示否定或阴性;±表示难以判断;?表示不明。
② 时间相关性:用药与不良反应的出现有无合理的时间关系。
③ 是否已知:不良反应是否符合该药已知的不良反应类型。
④ 去激发:停药或减量后,不良反应是否消失或减轻。
⑤ 再激发:再次使用可疑药品是否再次出现同样的不良反应。
⑥ 其他解释:不良反应是否可用并用药品的作用、患者病情的进展、其他治疗的影响来解释。
如果对照表中的5条标准,不能完全对应某条可能性时,建议采用保守原则或称之为不利于新药原则,即如果判断结果介于“很可能相关”与“可能相关”之间,应该判“很可能相关”或在信息不足的情况下评估为“可能相关”。当相关性选项中有“无法评价/判断”时,仅在因客观原因无法获得进一步信息,不足以判断因果关系时,才可选择这一选项。
为加强药品监管工作、促进临床合理用药、提升用药安全水平、保障公众健康权益,药品不良反应报告和监测必不可少。根据《药品不良反应报告和监测管理办法》(卫生部令第81号),药品不良反应报告和监测,是指药品不良反应的发现、报告、评价和控制的过程。药品不良反应监测方法可分为被动监测和主动监测。被动监测收集来自医务人员、患者、经营企业和文献检索等多种来源的自发报告。被动监测报告率低,适用于监测新的、罕见或严重的药品不良反应(adverse drug reaction, ADR)信号,但不适合验证风险信号,如某些药品存在安全风险,可能导致骨折或心肌梗死,这很难通过被动监测收集。故为加强风险信号的识别及验证能力、解决信号产生滞后性等问题,可通过主动监测工作采取强制性信息收集,以获取更全面的信息,实现更加及时的信号识别。
我国的主动监测工作尚处于起步阶段,方法主要为哨点医院集中监测。哨点医院是指通过国家药品不良反应监测中心认证,具有较强的药械不良反应/事件监测能力和开展药品重点监测和再评价能力的医疗机构。2016年,原国家食品药品监督管理总局启动了药品不良反应监测哨点联盟。国家不良反应监测2020年度报告指出,已在全国366家三级医疗机构建立药品不良反应监测哨点。
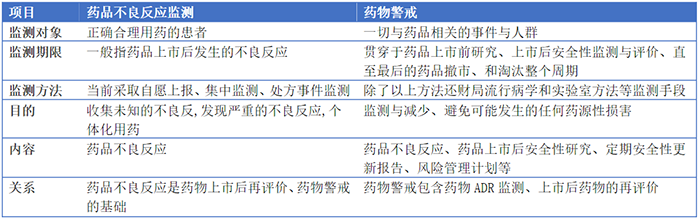
除了哨点医院联盟外,主动监测模式还包括ADR快速报告和智能搜索系统、触发器技术和文本信息提取技术。近年来,在药物不良反应监测体系基础上发展起来了药物警戒体系。药物警戒是有关发现、评价、认识和预防药品不良反应或其他任何药物相关问题的科学和活动。药物警戒与药品不良反应监测的比较见表2。
表2 药物警戒与药品不良反应监测的比较
不良反应监测工作技术含量较高。相信药品监管部门和技术监测机构基于监测数据提示的风险和多年积累的经验开展深入研究等,可稳步提升监测工作水平,使我国的药物警戒事业向更高层次迈进。
本文来源:医咖会
参考文献
1、高晨燕, 陈峰. ICH临床试验的统计学指导原则(Ⅱ)[J]. 中国临床药理学杂志, 1999
2、《临床试验精选案例统计学解读》,陈峰 于浩,人民卫生出版社,2015
3、《药品不良反应知识100问》,国家药品不良反应监测中心,2011
4、刘玉龙, 孙燕, 张明霞,等. 我国药品不良反应监测发展现状与展望[J]. 中国药业, 2019, 028(004):76-79.5、祝晓雨, 张伟光, 孙树森,等. 中国药物警戒的发展及文献计量分析[J]. 医药导报, 2019, 038(006):820-825.
6、王丹, 任经天, 董铎,等. 药品不良反应监测年度报告十年趋势分析[J]. 中国药物警戒, 2020, v.17;No.161(05):23-30.
7、药物临床试验 安全评价·广东共识,2020














