之前大家介绍了关于基础临床科研研究中的前四个研究热点,今天继续分享另外4大研究热点,分别是细胞自噬、细胞焦亡、铁死亡和外泌体。

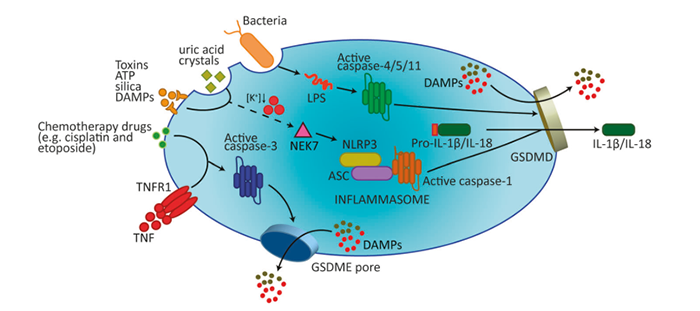
研究背景 细胞自噬又称为II型程序性细胞死亡,是所有活细胞的核心功能之一,是细胞为了应对饥饿、应激等条件刺激而出现的破坏蛋白质和细胞器,而细胞膜不被破坏,用以维持蛋白质和细胞器的质量和数量平衡的一种自我调控过程。根据自噬特征,自噬可分为:① 大自噬即常说的自噬,是吞噬细胞自身蛋白质或细胞器,并将其包被进入囊泡,与溶酶体融合形成自噬溶酶体;② 微自噬:是指溶酶体主动、直接吞噬胞浆成分的一种方式;分子伴侣介导的自噬是指需要一些分子伴侣,如 HSP70,来帮助未折叠蛋白转位入溶酶体,具有一定的选择性。许多自噬相关蛋白(如ATG)及其核心复合物如ULK1/2激酶核心复合物、自噬特异性III类PI3K复合物、ATG9A转运系统、ATG12和LC3泛素样结合等,参与自噬的起始、成核、延伸、成熟、融合和降解等过程。 该通路图来自Cell Signaling Technology,Inc.(www.cellsignal.com.) mTOR 激酶是自体吞噬诱导过程中的关键分子。饥饿条件下 AMPK 活化,mTOR 失活,活化的 AMPK 可以催化 ULK1的丝氨酸发生磷酸化从而促进自噬;而在营养充足时,AMPK 失活,mTOR 可与 ULK1 第 757 位丝氨酸结合抑制 ULK1-AMPK 互作,使ULK1 的失活从而最终关闭自噬信号。此外,凋亡和自噬两者之间有正、负信号通路调控的cross talk,比如营养缺乏时自噬同时具有促细胞生存的功能,而自噬过度会导致自噬性细胞死亡。 相关实验技术 1. 透射电子显微镜:观察到自噬体的形态结构,是检测的自噬体的金标准。发生自噬的细胞其细胞器如高尔基体、线粒体会彭大;视野下细胞轮廓完整,包内可见一个个由内质网形成的吞噬泡,此方法可以用来区别凋亡和坏死。 2. WB和IF: LC3是自噬体膜上标志性蛋白,存在于自噬发生的全部过程,持续定位在自噬体和自噬溶酶体,并最终在自噬溶酶体中降解。此外,相关的自噬标志物还有:ULK1、ATG14、ATG16等的表达变化。 3. 自噬流的检测:串联红色和绿色荧光标记载体 mRFP-GFP-LC3,随着自噬的发生,LC3带动 GFP 和 mRFP 荧光蛋白聚集在自噬相关的双层膜结构中,并在共聚焦显微镜下形成荧光点。细胞中红色荧光点的数目代表自噬体和自噬溶酶体的总数量,绿色荧光点的数目代表自噬体的数量,两者的相对数量代表自噬流从自噬体到自噬溶酶体的流动速度。 研究背景 细胞焦亡是有别于凋亡、坏死的细胞死亡方式之一。在病原体感染条件下,可激活细胞内的caspase家族蛋白,如caspase-1/-4/-5/-11的活性;将焦亡的明星分子蛋白GSDMD剪切活化,形成活化的GSDMA、GSDMD和GSDME,聚合到膜上,形成孔洞,继而细胞发生肿胀、胞质外流,细胞发生破裂,同时分泌一些免疫分子通过炎症因子来诱导炎症的产生,导致细胞焦亡的发生。 在典型的caspase-1 介导的细胞焦亡中,炎症配体的识别导致细胞内炎症小体等蛋白信号复合体活化。炎症小体的活化受到多种因素的调节,例如AIM2 识别细胞内双链DNA而激活,NLRP3认别ATP、晶体(例如胆固醇晶体)和病毒等分子从而诱导钾外流及NEK7的活化,再通过含有 CARD-结构域的衔接蛋白ASC 募集 caspase-1 ,使其活化。尽管炎症小体在其上游传感器中可能存在显著差异,但它们的活化配体都会导致caspase 1活化从而切割多个下游靶蛋白,如GSDMD被Caspase-1切割成N-末端和C-末端片段,后者在未剪切的GSDMD中发挥自身抑制活性。释放的N-末端GSDMD片段被募集到细胞膜的内部小叶中形成跨膜孔,导致钾流出和水流入,从而使质膜电位不稳定并导致细胞破裂。 Gasdermins形成膜孔引起焦亡示意图1 相关实验技术 1.WB 检测活化的 caspase-1、caspase-4、caspase-5、caspase-11 及 GSDMD(前体及剪切体)、caspase-3 的表达; 2.ELISA 检测 HMGB1,以确定 DAMPs 的释放检测 的表达; 3.ELISA 检测 IL-1a、IL-18 ,以确定炎症因子的释放检测; 4.细胞形态:质膜完整性缺失,胞质物质释放到细胞外环境。 研究背景 铁死亡是一种依赖于铁积累而导致细胞出现脂质超氧化(毒性脂质活性氧簇的聚集和多不饱和脂肪酸的消耗)、非凋亡性氧化的新型细胞死亡形式,在形态、遗传、代谢等方面都不同于细胞凋亡、坏死、焦亡和自噬这些细胞死亡类型。 在一系列脑退行性疾病,如阿尔茨海默氏症、亨廷顿氏症、帕金森、中风、脑损伤以及肾退行性疾病等的发生发展中均扮演重要角色。同时,铁死亡在肿瘤中被认为是肿瘤治疗的抑制靶点,可以作为癌症治疗的新手段。铁死亡的发生受严格而复杂的机制调控,主要调控方向有: ① 抑制systrm X c-诱导细胞铁死亡; ② 抑制GPX4诱导细胞铁死亡。该分子是对抗细胞铁死亡的关键因子,是铁死亡诱导剂erastin、RSL等因子的关键靶点; ③ VDACs介导的铁死亡。Erastin与VDACs 互作可引起线粒体功能障碍,ROS增多,进而引发细胞铁死亡; ④ P53介导的细胞铁死亡。抑癌基因p53可参与诱导SAT1的转录表达,导致细胞内脂质过氧化物产生增加,进而增强细胞对铁死亡的敏感性。铁死亡作为一种新型的细胞死亡方式,其研究将为临床疾病的治疗带来新的方向。对于铁死亡发生的分子机制深入探索以及其在疾病中作用的研究具有极大现实意义及临床应用价值,同时这也成为了今后铁死亡的主要研究方向。 铁死亡敏感性调控信号通路2 相关实验技术 体外诱导铁死亡方法及试剂 b. GPX4 抑制剂,包括 RSL3、ML162; c. GPX4 清除剂,例如:FIN56、CoQ10; d. GPX4 活性抑制剂或是脂质过氧化激活剂, 如 FINO2。 检测指标及方法 b. 脂质过氧化相关因子检测:ALOXs( 包括 ALOX5,ALOX12,ALOX15B,ALOXE3,ALOX15ALOX15B), AKR1C1-3, ACSL4,ATP5G3。 c. 谷氨酰胺相关因子检测:FANCD2,GCLC/GCLM,GLS2,GPX4,GSS。 d. 铁离子相关因子检测:HSPB1/5,NCOA4,TFRC和铁死亡效能蛋白相关:KODh。 研究背景 外泌体在1980年首次被发现后,其被认为是细胞排泄废物的一种方式,被认为是“无用之物”, 而自从2013年诺贝尔生理医学奖颁发给囊泡运输调节机制的发现者后,将外泌体研究推向了新的热潮,使得曾经的“无用之物”变为科研关注的“新宠儿”。外泌体(exosomes)直径在40~160nm之间,由细胞内的多囊泡体(MVBs)产生,与质膜融合形成,并通过胞吐作用分泌到胞外的特殊囊泡。从分布上看,外泌体几乎是无处不在的,分布非常广泛,几乎人和动物的所有体液中均有分布,甚至在细菌、植物、细胞上清中也可检测到外泌体的存在;功能上外泌体又几乎“无所不能”,外泌体就像是一个多能的“小信使”,富含丰富的的蛋白、RNA、DNA、代谢物,其表面携带有具有重要功能的膜蛋白,参与调控不同的生物过程,如细胞增殖与凋亡、转移与侵袭、血管生成、免疫应答、细胞分化、代谢调控等。 近年来关于外泌体的研究,功能方向主要集中在肿瘤的形成、耐药性、分子标志物的检测,如可以通过RNA-seq获得较多的转录本数据,根据测序结果筛选差异基因,再在大量样本中做差异基因的验证,然后通过生物信息学分析ROC、KM曲线,分析出差异基因和临床疾病的相关性;较深层次的分子研究机制还需要在细胞水平、动物水平做细胞功能学的验证,以及联合和分子检测手段探究具体的作用机制。 细胞外囊泡在肿瘤发展中的作用3 相关实验技术 外泌体的分离 超速离心法、蔗糖梯度离心、PEG共沉淀法、试剂盒法、免疫磁珠法等是目前使用比较多的抽提方法。对抽提后的外泌体,需要使用若干检测手段检测其抽提的质量,主要方法有: TEM-看形状、轮廓:透射电镜具有较高的分辨率,能够成像 <1 nm 的物体。在电镜视野中,可观察到双层囊膜结构的外泌体呈茶托式一侧凹陷的半球型。 NTA-测尺寸、浓度: 纳米粒子跟踪分析 (Nanosight Nanoparticle Tracking Analysis,NTA 鉴定)用于确定外泌体的浓度和尺寸分布。 WB、ELISA、流式- marker检测:外泌体的标记物主要有CD9、CD63、CD81、TSG101、ALIX、annexin、Rabs、tubulins,分子伴侣如热休克蛋白家族HSPs,核糖体蛋白等,通过检测这些标记物以对外泌体进行鉴定。 注:实验中并不一定所有标志物都要逐一鉴定。 关于基础临床科研中所涉及到的8大研究热点小编暂且介绍到这里,后续会针对各研究热点再和大家做科研思路方面的策略分享。大家如果有其他感兴趣的话题,欢迎留言回复哦~~ 【参考文献】 1. Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019 Jan;26(1):99-114. doi: 10.1038/s41418-018-0212-6. Epub 2018 Oct 19. PMID: 30341423; PMCID: PMC6294779. 2. Stockwell BR, Friedmann Angeli JP, Bayir H, Bush AI, Conrad M, Dixon SJ, Fulda S, Gascón S, Hatzios SK, Kagan VE, Noel K, Jiang X, Linkermann A, Murphy ME, Overholtzer M, Oyagi A, Pagnussat GC, Park J, Ran Q, Rosenfeld CS, Salnikow K, Tang D, Torti FM, Torti SV, Toyokuni S, Woerpel KA, Zhang DD. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 2017 Oct 5;171(2):273-285. doi: 10.1016/j.cell.2017.09.021. PMID: 28985560; PMCID: PMC5685180. 3. Maacha S, Bhat AA, Jimenez L, Raza A, Haris M, Uddin S, Grivel JC. Extracellular vesicles-mediated intercellular communication: roles in the tumor microenvironment and anti-cancer drug resistance. Mol Cancer. 2019 Mar 30;18(1):55. doi: 10.1186/s12943-019-0965-7. PMID: 30925923; PMCID: PMC6441157.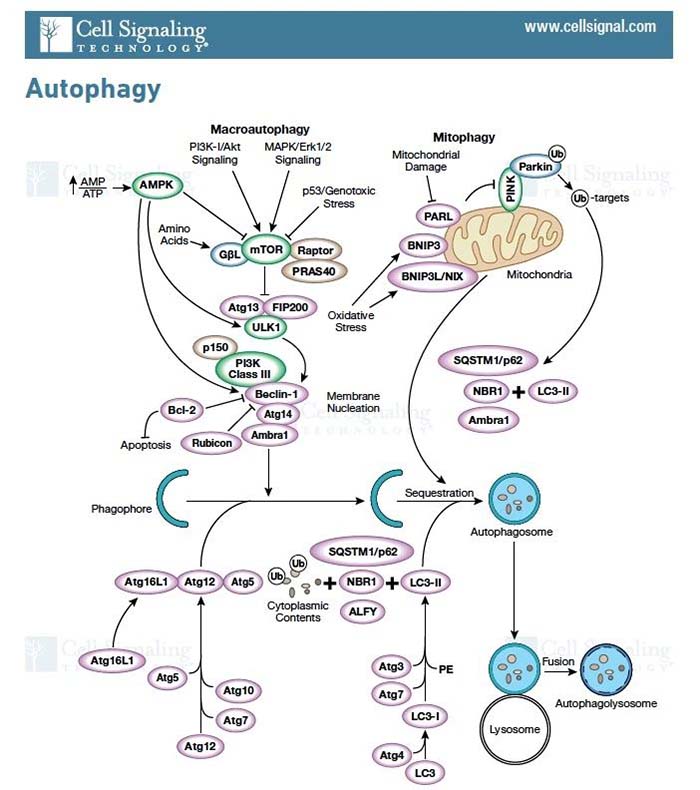


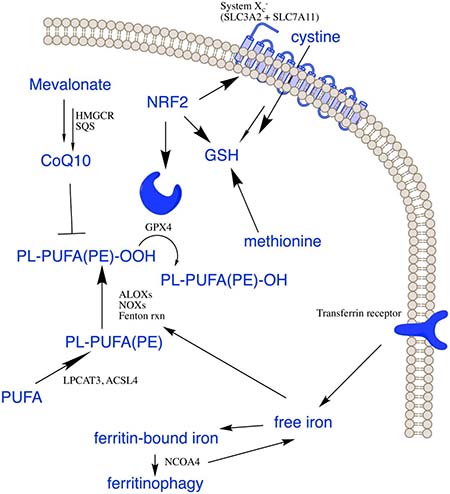
a. XC- 抑制因子,例如 erastin 或其类似物、柳氮磺吡啶、谷氨酸、索拉非尼;
a. 细胞活力测定:CCK8 检测铁死亡抑制剂和干预因素一起处理后的细胞的活力回复实验,若死亡回复即可确认为铁死亡。















