题目:Identification and validation of hypoxia-derived gene signatures to predict clinical outcomes and therapeutic responses in stage I lung adenocarcinoma patients
背景:基于肿瘤-淋巴结-转移(TNM)分期系统不能准确预测Ⅰ期肺腺癌(LUAD)患者的生存期和治疗方案。因此,需要鉴定可以辅助治疗的高风险的Ⅰ期肺腺癌患的可靠生物标志物。
方法:本研究对14个数据集的1400例Ⅰ期肺腺癌患者的转录组数据和临床参数进行分析。结合生物信息学分析和机器学习方法,建立缺氧相关特征预测Ⅰ期肺腺癌患者的总生存期和ICB治疗反应。此外,对不同风险亚群进行富集通路分析和拷贝数变异分析。
结果:缺氧是影响Ⅰ期肺腺癌患者总生存期的主要危险因素。缺氧相关的预后风险打分(HPRS)可以更好的预测总生存期,而在ICB治疗中缺氧相关免疫反应打分(HIRS)优于传统的生物标志物。构建决策树和列线图,优化风险分层和风险评估。
结论:本文提出的缺氧相关特征是准确预测Ⅰ期肺腺癌患者的临床结果和治疗效果的生物标志物。
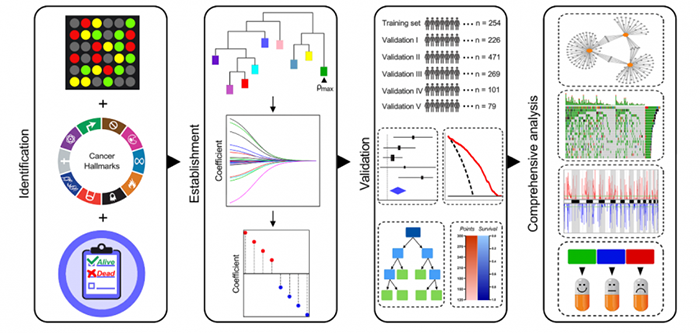
流程图
结 果
1. 本研究分析流程
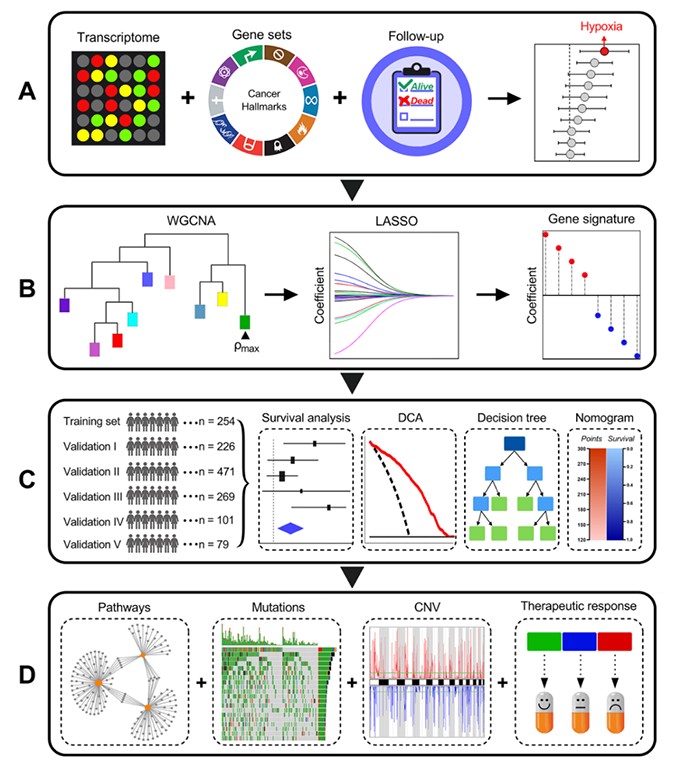
图1 流程图
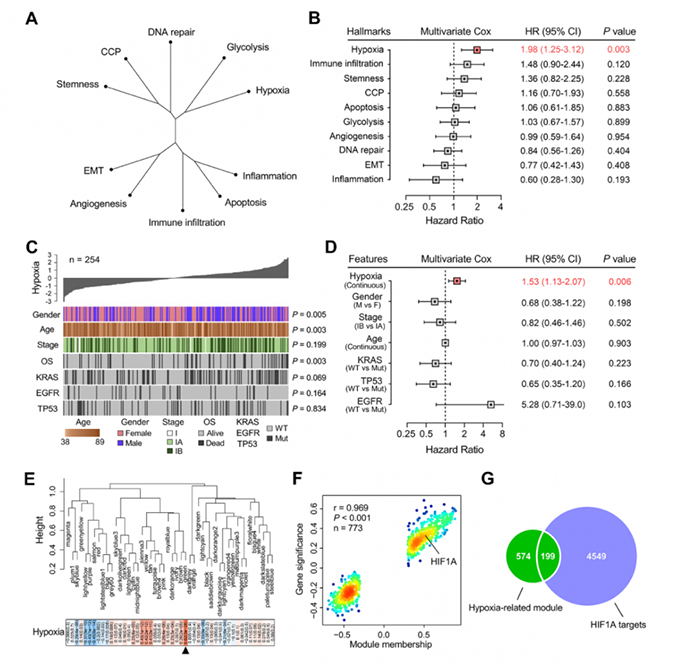
图2 缺氧是Ⅰ期肺腺癌患者的主要危险因素
3. 参与Ⅰ期肺腺癌缺氧相关的候选基因
NMF将254个样本分为两个亚群(图3A),GSEA分析表明簇1与低氧显著相关(图3B)。簇1中血管生成,炎症和糖酵解等ssGSEA打分显著提高(图3C)。来源于同一个LUAD患者的77个细胞同样分为两个亚群(图3D),其缺氧水平不同(图3E)。对两个簇进行PCA分析(图3F),TCA循环和糖酵解比例分析(图G)。根据这199个基因的表达矩阵将来源于CCLE的LUAD细胞系分为三个簇(图3H),其缺氧水平逐渐下降(图3I)。PCA结果表明缺氧和正常状态下的样本分为两类(图3J)。
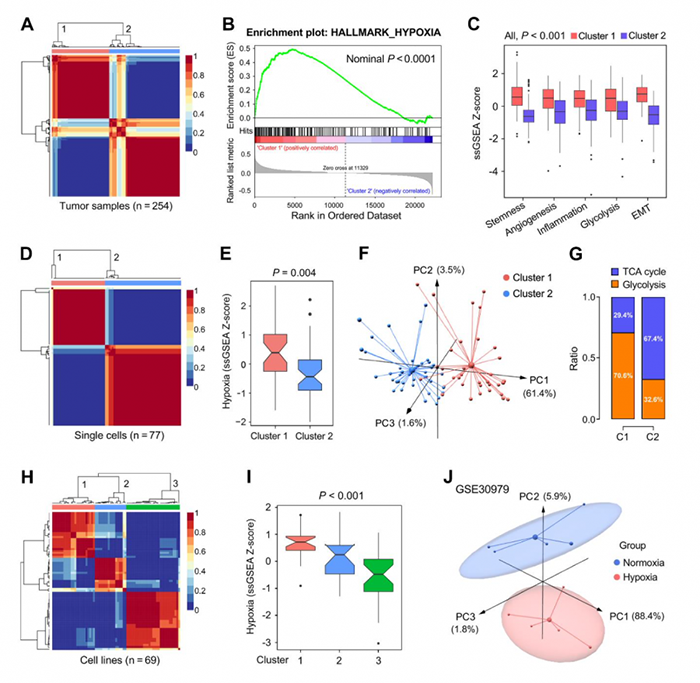
图3 不同水平验证199个缺氧相关基因的表达
4. 缺氧相关预后特征的构建和验证
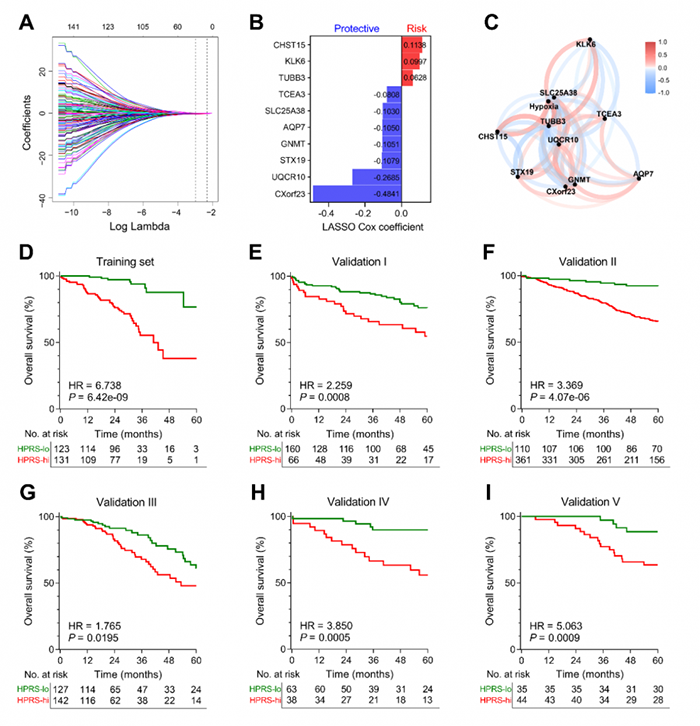
图4 缺氧相关预后特征的构建和验证
5. HPRS与传统特征的预后和预测能力的比较
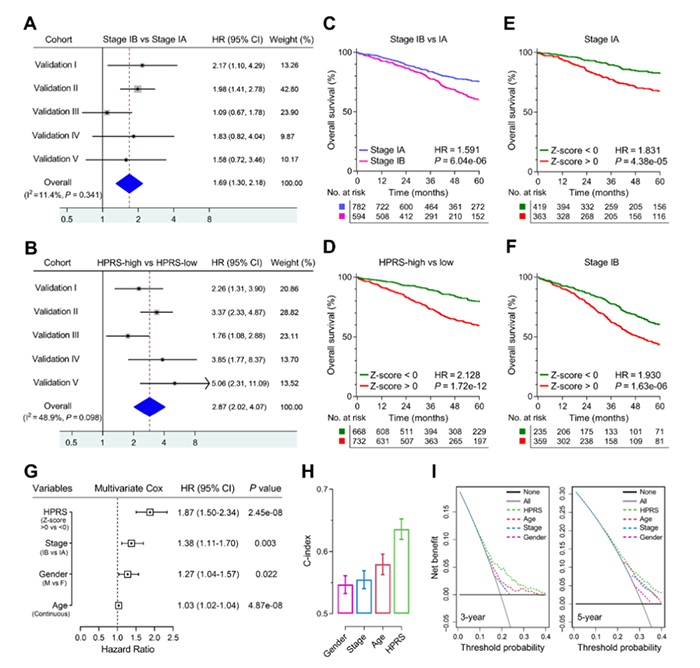
图5 HPRS与传统特征的预后和预测能力的比较
6.构建模型优化Ⅰ期肺腺癌患者的风险分层和生存预测
使用HPRS和其他临床病理特征构建列线图(图6C)。使用列线图预测3年和5年生存率的准确性较高(图6D),表明列线图的预测准确性。与其他临床病理特征相比,列线图的生存预测性能最高(图6E)。
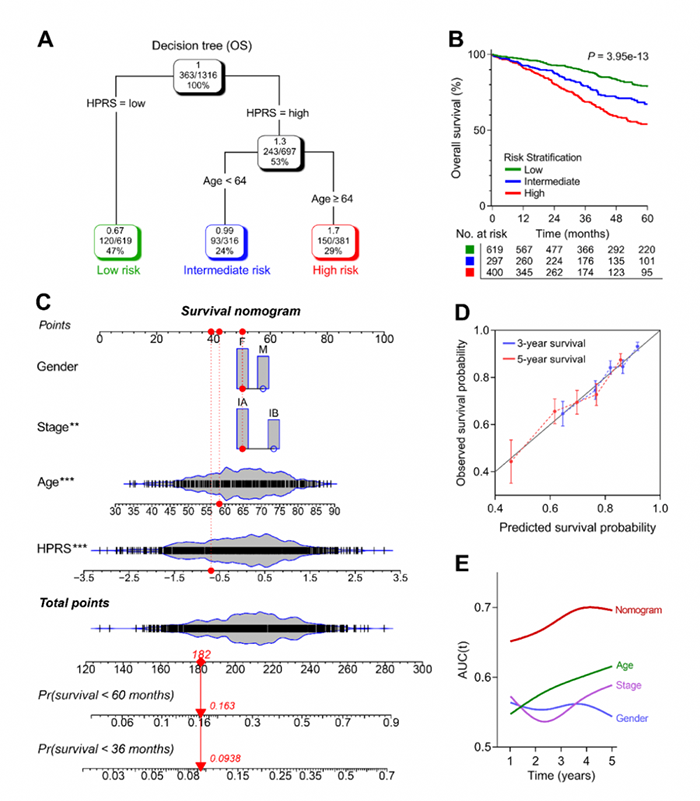
图6 生存决策树和列线图
7. 对不同风险亚群进行富集通路和基因组变异的全面分析
每个亚群中发生突变频率排名前20的基因见图7D和7E。TP53是发生突变频率最高的基因(图7F),与缺氧显著相关。每个亚群发生的TP53突变见图7G。生存分析见图7H和7I。在HPRS高的亚群中发生KRAS-TP53互斥突变的情况(图7J)。HPRS高的亚群TMB显著升高(图7K)。
在两个亚群中均发生到拷贝数的增加和缺失,HPRS高的亚群发生拷贝数变异的区域更多(图7L和7M)。其中癌基因FGFR1,E2F1,KRAS和MET等在HPRS高亚群中发生拷贝数增加(图7N)。HPRS高的亚群拷贝数与mRNA表达呈正相关(图7O)。
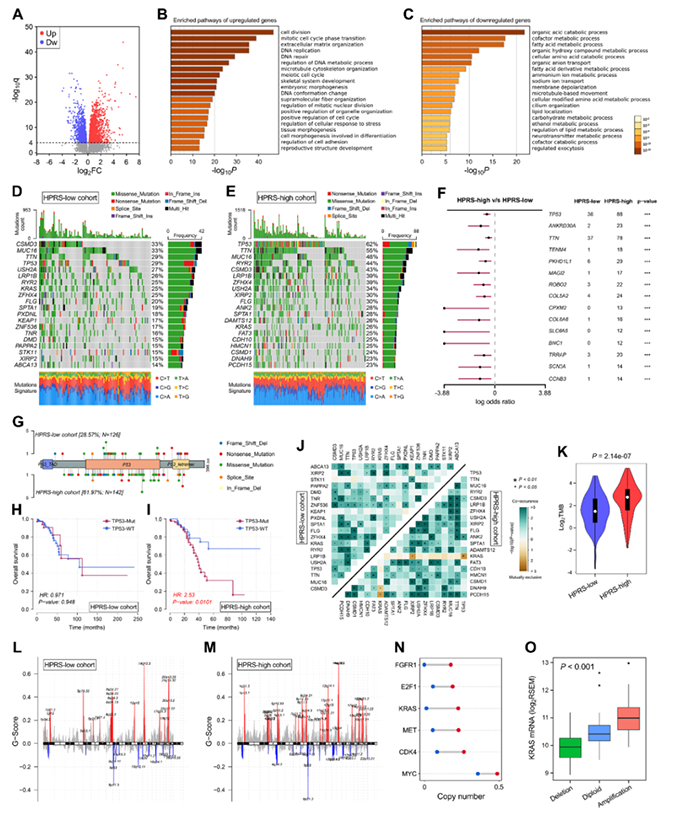
图7 不同风险亚群的富集通路的基因组变异的全面分析
8.缺氧特征预测患者的治疗反应
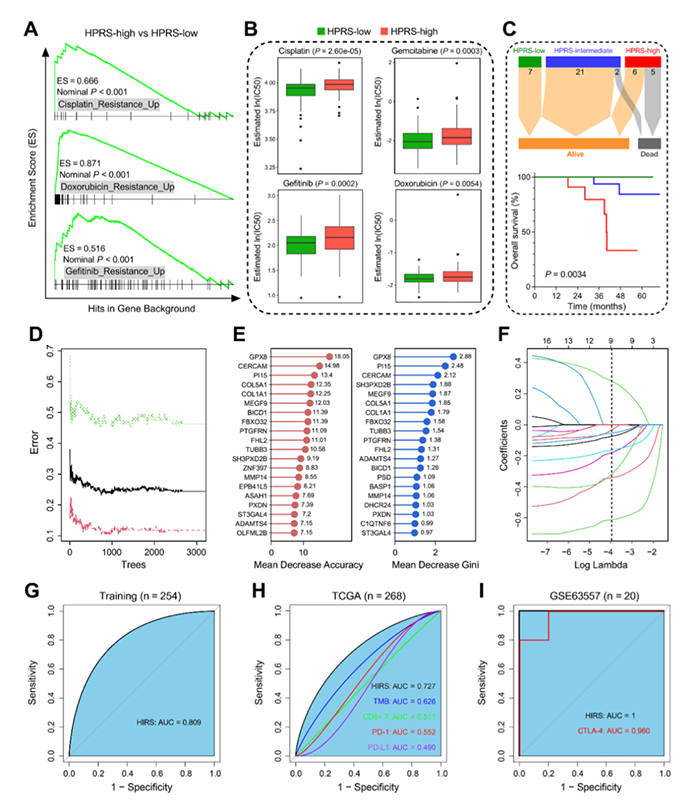
由于缺氧会影响癌症患者的免疫疗法的效果,作者使用RF和LASSO算法开发了一个缺氧相关的基因特征,可以预测ICB治疗反应。得到两个参数最优值(图8D),根据免疫疗法反应的重要性对199个缺氧相关候选基因进行排序,两种排序方法共有的基因有16个(图8E)。随后进行LASSO回归分析,10倍折叠交叉验证去除过拟合影响,最优值λ为0.0188(图8F),最终得到9个基因。训练集HIRS预测免疫治疗反应的AUC为0.809(图8G)。在TCGA数据集中,与一些常见的免疫治疗生物标志物相比,HIRS的AUC最高(图8H)。
结 论
作者14个数据集的1400例Ⅰ期肺腺癌患者的转录组数据和临床数据进行分析。确定了缺氧是Ⅰ期肺腺癌患者的主要预后危险因素,构建了两个缺氧相关特征,可以预测Ⅰ期肺腺癌患者的总生存期和免疫治疗反应。本文的亮点在于作者构建了两个的缺氧相关模型并使用验证集进行验证。但本文仍然存在一定限制,作者使用的数据可能存在肿瘤异质性和多平台引入的偏差,仍然需要进一步实验验证阐明LUAD患者中缺氧相关基因的生物学功能。
文章来源:生信发文助手













