导 读
空间转录组学是单细胞分析后的下一波热潮,这是一个非常活跃的领域,新的技术开辟了新的科研角度。该技术不仅可以获取转录组数据并解析细胞在组织中的位置,还能够在空间背景下对基因表达进行更细致的研究。空间转录组学的分析系统开发和生信数据处理将会是该领域各大公司的研发重点及商业价值所在。
欢迎进入空间组学时代
瑞典的研究人员开发了一种方法,可以对固定的,染色的组织进行成像,透化,并将mRNA附着在一系列标签化的寡核苷酸上。RNA被逆转录;cDNA被测序并产生空间转录组信息。
图片来源:Adaped with permission from ref.4, AAAS

空间技术通过定位表达的基因来帮助构建地图谱。这里,seqFISH +用于测量小鼠皮层中的10,000个基因。
图片来源:Cai lab, Caltech, I. Strazhnik; adapted with permission from ref.5, Springer Nature.
其他空间组学技术
在蔡龙看来,scRNA-seq技术可以为研究人员提供单细胞分辨率,但目前,组织成像技术还达不到。分辨率对于科学研究至关重要,因为在人们感兴趣的组织区域包含有多种细胞类型,如果没有足够的分辨率,那么就会出现“完全错误的图像”,并且如果一种方法的效率比较低,那么一些信号就可能会被丢失,例如,以10个拷贝或更少的拷贝表达转录因子的mRNA。蔡龙认为分辨率是目前许多空间方法的一个弱点,而分辨率低将会导致“最终你必须放入一个测序仪”。高通量基因组学技术已经领先一步,但对于现在测序所能做的几乎所有事情,未来空间分析亦可以做到,甚至做得更好。
Evan Macosko是Broad研究所的一名医学科学家,他一直热衷于利用基因组学对细胞和组织进行新的测量。他在哈佛医学院Steve McCarroll的实验室做博士后时,参与开发了Drop-seq。使用Drop-seq,只需要一天时间就可以制备数千个测序文库。该技术利用微流控装置,当细胞穿过狭窄的通道后,最终被封装在带有磁珠的液滴中,每个磁珠都带有一段由12个碱基对构成的独特的寡核苷酸序列;接着细胞在液滴中裂解,mRNA被磁珠上的寡核苷酸序列标记,然后逆转录成可用来测序的cDNA。Macosko还和Fei Chen一起开发了Slide-seq技术。Fei Chen是扩展显微镜的共同发明人。Macosko说,Slide-seq技术利用了“DNA标签策略和其他一些技巧”。随着smFISH的进化,Slide-seq成为了他实验室里一个主要的工具。多重原位杂交策略是非常有用的,但是它们很耗时并且对技术有一定的要求。Macosko说:“这不是传统的分子生物学或细胞生物学实验室可以立即建立起来的东西”。他寻求了一种利用基因组实验室中基于Illumina的广泛测序基础设施,在全基因组范围内达得细胞或近细胞水平分辨率的方法。他和他的团队应用了Drop-seq的标记方案,从50微米的磁珠开始,然后转变成了10微米的磁珠。Chen实验室的Sam Rodriques和Macosko实验室的Robert Stickels发现了如何将磁珠单分子层排列成二维阵列,并开发了一种将RNA转移到磁珠上的试验方案。Macosko说,这“说起来容易做起来难”。他说,Slide-seq的输出接近单细胞分析的结果,这使得使用单细胞计算工具成为可能,“就像磁珠是单细胞一样”。他们使用了velocyto和Monocle等单细胞分析工具。在其他项目中,他们已经使用这种方法来研究晶状体和胚胎皮层的发育。他说低分辨率的空间技术每个像素有太多的细胞,这使得去卷积更加困难。由于Slide-seq使用了磁珠,“我们可以继续让磁珠更小,分辨率更高”。该团队一直在研究提高这种方法的效率。他说,Slide-seq v2的mRNA捕获效率接近于scRNA-seq技术。效率很重要,因为对于罕见的转录本来说,需要足够的信息才能准确地将它们分配到特定的位置。但是目前关于Slide-seq商业化的讨论还处于早期阶段。

庄小威开发了超分辨率显微镜方法STORM。单细胞基因组学使她想到了融合基因组学和成像技术。
图片来源:Harvard University
空间计算
Macosko预见了计算开发的一个阶段,该阶段将围绕寻找空间变异基因或寻找利用空间信息的轨迹。Shendure说,尽管付出了很多努力,但管理数据和平台集成仍然是一个巨大的挑战。每一个实验都会产生大量的数据,研究人员需要决定哪些数据需要保存,哪些数据需要丢弃,以及不想偏离基因组学中公开数据共享的原则。

空间转录组学揭示了在小鼠等基于干细胞的发育模型中表达的体发生标志物。
图片来源:Hubrecht Inst.A. van Oudenaarden.
数据处理
在艾伦研究所,像大脑细胞分类这样的大型项目就像处理大型数据集一样司空见惯。艾伦研究所的Tasic说,当观察单细胞和空间转录组数据时,能够发现每个细胞有成千上万的特性,并且能够很快地达到标准分析的阈值,这让她们感到十分惊讶。她说:“数据矩阵变得难以管理”。她们也与非生物学处理大规模数据矩阵的人合作。她说,未来的计算之路既令人生畏又令人兴奋。她在研究生院时关于测量所有单细胞的所有基因的梦想开始实现。除了数据大小和维度之外,她和她的团队还致力于整合和纠正批次效应。即使使用相同的模式捕获的数据也可能在批次处理之间略有不同,所以必须进行标准化。为了整合影像、测序和电生理学等多种模式,她和她的团队构建了聚类方法,并借鉴不同类型的机器学习方法。
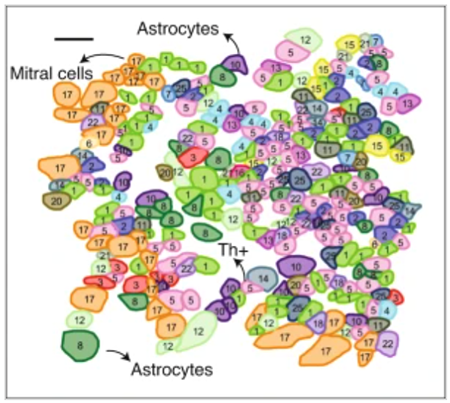
空间技术可以揭示组织中复杂的细胞类型混合物-这是小鼠大脑的嗅球。
图片来源:Cai lab, Caltech, I. Strazhnik Adapted with permission from ref.5, Springer Nature.
Van Oudenaarden说,确实存在很多机会可以通过计算将scRNA-seq与空间组信息结合,从而能够在空间中定位单个细胞,进而生成可供参考的图谱以及相关工具。他对在不使用图谱的情况下利用杂交参考数据库重建空间图谱的计算很感兴趣。NovoSpaRc正是其中一种计算方法。它对基因表达在整个组织切片中变化情况进行假设,因此无需图谱就可以进行基因表达制图。Van Oudenaarden认为,我们面临的一个重要问题是如何从组织中获得更多的信息。这些信息可以了解生物信息的核心,即生物的“骨骼”,这将成为一个“更大的难题”。对他来说,单细胞组学与空间技术的结合“确实是一种进行假设的方式”,并需要独立的数据对结果进行验证及确认。
商业需求
Shendure提到,空间组技术拥有悠久的历史,例如Mats Nilsson以及George Church等实验室早在十年前就已经开始进行基因分型或直接在组织切片上进行测序。此外,在过去的一两年里,单细胞领域及其相关技术已经相当成熟并成功转化为应用广泛的商业化产品,这也是空间组技术能够蓬勃发展的部分原因。“尽管如此,商品化仍然是许多研究者面临的挑战之一”。Shendure在谈到现代空间组技术的发展时说道,“大量更优秀的方法仍然是定制的,并只能在一个或少数几个实验室中使用”。目前存在的问题是,其他团队如何更便捷地获得并实施这些方案。曾红葵认为,科学家们首次完成的工作往往既困难又昂贵,但技术的发展能够改变这一点。商业化对于推动单细胞测序的发展至关重要,因此空间组技术也有可能出现这种情况。Tasic这样说,“我非常期待在单细胞水平上发挥作用的空间转录组学的商业化方案的出现”。
2019年,NanoString开始销售其用于空间组分析的仪器GeoMx。该设备早期已经在研究者中进行测试。一些实验室使用机器原型进行试验,其他实验室则需要将样品发送到公司的西雅图总部,并远程使用该仪器。早期,GeoMx可以捕获约100个mRNA,NanoString总裁兼首席执行官Brad Gray说,现在这个数字已经超过22,000,展现该领域极快的发展速度。Gary说,NanoString是西雅图系统生物学研究所的衍生产品,它采用了光学分学标签技术,而现在,它完全是关于空间分析的。研发部首席科学家兼高级副总裁裁Joe Beechem说,GeoMx平台的早期使用者主要是进行肿瘤免疫学方面的研究。例如,有实验室试图研究T细胞是否是在肿瘤周围而不是进入肿瘤内部发挥作用。有一天,就在发表演讲之前,他在餐巾纸上写下了公司的寡核苷酸标签如何在空间上分辨组织并在第二代测序仪上进行读数记录的。该公司先前已经开发出一种,通过可被光裂解的小分子连接片段,将DNA标签添加到抗体上的方法。他的想法是在组织玻片上铺开这些连接片段和标签,它们可捕获mRNA,之后显微镜对组织进行拍照,发出的光可把DNA标签解离下来。然后对mRNA和DNA标签进行测序。正如Gray所解释的那样,他们的客户长期以来一直要求研究全转录组,并期望获得更高的分辨率直至亚细胞区室的方法,这样他们就可以问:“它是存在于细胞表面?是存在于细胞核中?还是附着在某些细胞器上?”。他认为,市场将分为两种工具类别:一类是,以NanoString公司的GeoMx数字化空间分析系统和10x Genomics公司的Visium空间基因表达为代表,可高通量、弹性选择感兴趣区域的分析系统;另一类是,具有细胞和亚细胞分辨率,可能不会覆盖全转录组,但一次会覆盖数千个基因的分析系统。NanoString刚刚推出了具有单细胞分辨率的GeoMx数字化空间分析系统。NanoString新技术也使用了可光裂解的标签,可对包括福尔马林固定石蜡包埋的组织在内的组织进行基因表达谱分析。应用方面,它可用于研究死于COVID-19的人尸检样本的空间信息。Beechem说,有了这种技术,研究人员将拥有集合以往所有分子工具的全部力量。
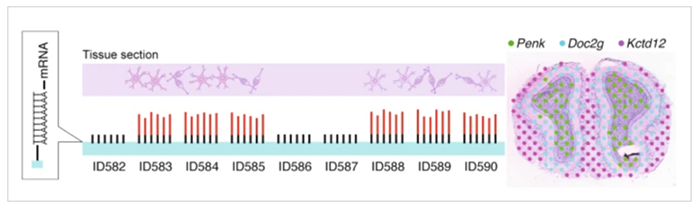
https://www.biorxiv.org/content/10.1101/2021.01.17.427004v1
华大生命科学研究院正在开发一种用于解析基因空间表达分析的高分辨率方法。华大集团首席执行官、华大生命科学研究院院长徐讯表示,该想法是在单细胞测序和细胞在组织中位置的空间分析之间架起一座桥梁,它们将共同塑造功能和结构的研究。他关注了其他公司在这一领域的活动,相信华大的方法将具有最高的分辨率。徐讯说,这种方法在每个细胞中捕获数百个数据点。它以纳米阵列的形式封装在硅芯片上,这种纳米阵列采用了半导体工业的光刻技术。华大基因使用这种方法来解析DNA-蛋白质的相互作用,华大科学家陈奥说,他和他的同事正在研究将细胞或组织嵌入这些芯片的方法,以产生高分辨率的空间解析数据。硅芯片阵列的方形隔室每个都有圆形区域,每个区域都包含带有标签的DNA纳米球,可以用传统的广域成像技术进行解析。DNA纳米球是由捕获的转录本制成的环化cDNA束,其中包括可用于华大测序平台的引物和接头。每个标签的读出均以阵列上的特定间距作为其空间地址。徐讯说,芯片上的轨迹线给出了每个细胞的测量坐标。这种空间方法借鉴了华大从Complete Genomics公司收购的技术,预计将于2021年发布。华大已经制造出了用于小鼠大脑空间分析的芯片,每个纳米球bin(可以理解为分辨率)大约有2,000-4,000个基因转录本。该系统最终可以帮助研究人员建立人类和模式生物参考组织图谱;他们也可以使用这种空间技术来评估遗传变异如何影响组织功能(例如在癌症中),或者将其用于跨物种比较方法(例如基于组织的器官进化和适应性研究)。
涉及空间领域的公司活跃于软件的开发。10x Genomics公司研发高级副总裁Schnall-Levin的团队致力于开源软件的开发,他说,信息学一直是公司的核心部分,研究人员可以将其算法和工具添加到10x Genomics分析流程中。正如徐讯所解释的那样,他们的团队致力于开发交互式可视化工具“为人们提供组织的真实视图”。NanoString公司的Gray说:“Joe最大的研发部门现在是软件部门”。该公司的程序员比分子生物学家和工程师还多。
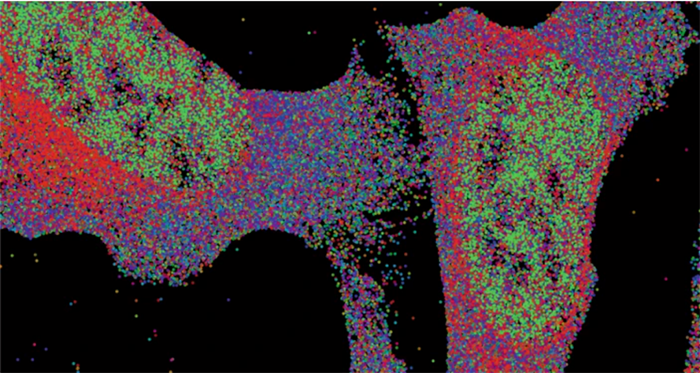
借助MERFISH,庄小威实验室捕获了小鼠大脑单个细胞中10050个基因的表达。来自不同基因的RNA分子以不同的颜色显示。
图片来源:X. Zhuang laboratory, Harvard U./HHMI
图谱发展
空间分析对于建立大脑起始细胞-普查网(BICCN)至关重要。BICCN是一个由美国国立卫生研究院(NIH)资助的项目,该项目由许多实验室共同合作,绘制人类、小鼠和非人灵长类动物的大脑参考图谱。它涉及成像、电生理学和诸如转录组学和表观基因组学的分子遗传学分析。艾伦小鼠大脑图谱的研究始于所有小鼠基因的原位表达谱分析,以显示解剖结构和空间基因表达模式。指导BICCN小鼠全脑图谱项目的曾红葵说,它是一个已被广泛使用的参考数据库。Tasic说,该团队正在建立小鼠和人脑中细胞类型的“周期性系统”。她领导了一个BICCN项目,该项目涉及用于全脑标记的特定细胞类型工具的开发,以及以特定细胞类型方式研究神经回路的方法。研究团队很快将拥有特定细胞类型的参考图谱,他们可以在上面绘制自己的发现。BICCN团队最近发表了一份哺乳动物初级运动皮层的多模态细胞普查和图谱8。曾红葵说,BICCN第二阶段已经开始。在这些新项目中,有一些致力于细胞类型靶向工具开发的项目,这些工具可以应用空间和分子信息,扰动细胞并且表征其在神经回路和行为中的作用。

艾伦脑科学研究所所长曾红葵(左)和艾伦研究所Bosiljka Tasic。
图片来源:Allen Institute for Brain Science
对于最近的小鼠初级运动皮层图谱,研究小组指出,单细胞基因组已经席卷了包括神经系统科学在内的整个生物学领域,并且催生了从实验室能够对表型进行分类和描述,转变为具有机制和解释性的分子遗传框架的脑组织细胞基础,其中包括完整的转录组。为了通过转录组细胞类型映射小鼠初级运动皮层中300,000多个细胞的空间结构,他们选择了庄小威的MERFISH9。他们将MERFISH与其他方法结合使用,例如Patch-seq,通过电生理学测量细胞,然后进行测序。他们分析并比较了小鼠、狨猴和人类转录组细胞类型。之后,他们选择了超过250个基因的一组数据进行成像,然后通过单细胞表达谱进行聚类,发现与单核和单细胞RNA-seq鉴定的聚类具有“极好的对应性”。这使得他们能够辨别细胞类型的空间分布,并获得对传统定义皮层进行了改进的皮层的视图。他们还指出了沿内侧、外侧和前后轴的空间分布。有时会爆发出关于大脑制图的分歧,但是Tasic认为,先进的技术将慢慢帮助解决这些分歧,而这些分歧有时是源于实验时使用了不同的方法。有了通用的坐标系,分歧就可以转移到例如关于功能的必要性讨论上。曾红葵说:“在很多情况下,一个基因通常不足以鉴定一种细胞类型”。Tasic针对细胞类型方面说:“通常是不存在非黑即白这种情况的”, “有很多表达水平不同的基因,它们共同构成了一个真正的细胞”。曾红葵说,检测单个细胞中表达的数千个基因的能力“已经极大地改变了这一领域”。空间转录组学则又增加了其丰富性,研究人员可以通过一种空间定位的方式能够观察到细胞内的许多基因。
空间未来
作为显微学家,庄小威很高兴看到成像和单细胞基因组分析领域越来越近。KTH的Ståhl十分期待高分辨率的空间转录组学。他说:“也许像10微米那样的分辨率是最佳选择”,这样每个像素就可以提供足够多的数据。许多现有的方法引领着单细胞RNA测序发展,同时也为定量的基因表达提供了最高的灵敏度读数。不过希望有一天,对于整个转录组范围的单细胞空间分析“我们可以完全摆脱单细胞测序”。
曾红葵看到了很多未来的机会。她说:“在很多情况下,这些技术还不是很完美” ,“我们希望有更多更好的东西,以扩大技术规模,并能够常规高效地测量数千个基因”。Tasic说,空间方法将成为标准方法。有一天,人们将利用组织获得空间解析的单细胞遗传信息。人们对该领域论文的普遍反应可能是:“哦,您没有测量所有基因?为什么不呢?”。
参考文献:
1. Crossetto, N., Bienko, M. & van Oudenaarden, A. Nat. Genet. 16, 57–66 (2015).
2. Lein, E., Borm, L. E. & Linnarsson, S. Science 358, 64–69 (2017).
3. Bergenstråhle, J. & Lundeberg, J. Bioessays 42, 1900221 (2020).
4. Ståhl, P. L. et al. Science 353, 78–82 (2016).
5. Lubeck, E., Coskun, A. F., Zhiyentayev, T., Ahmad, M. & Cai, L. Nat. Methods 11, 360–361 (2014).
6. Eng, C.-H. L. et al. Nature 568, 235–239 (2019).
7. Rodriques, S. G. et al. Science 363, 1463–1467 (2019).
8. BRAIN Initiative Cell Census Network (BICCN) et al. Preprint at bioRxiv https://doi.org/10.1101/2020.10.19.343129 (2020).
9. Chen, K. H., Boettiger, A. N., Moftt, J. R., Wang, S. & Zhuang, X. Science 348, aaa6090 (2015).
10. Su, J.-H. et al. Cell
https://doi.org/10.1016/j.cell.2020.07.032(2020).
译者:姜宇佳 李永平 郑惠文 卫彦蓉 涂桢铖 李金秀 刘龙奇
原文发表自Nature Methods,内容有修改。
转自:测序中国













