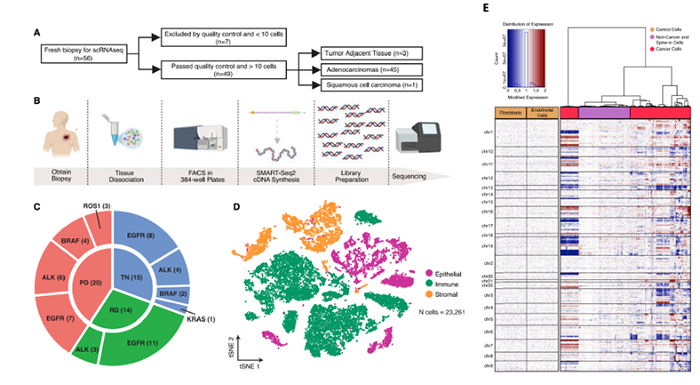
肺癌是人类最普遍的癌症之一。基于单细胞RNA测序(scRNA-seq),研究人员已经在肺癌的基因表达谱、TME和细胞异质性等方面做出广泛研究,而该项技术临床应用较少。2020年,来自陈-扎克伯格生物中心和加州大学旧金山分校的研究人员收集了,30名患者在靶向治疗前和治疗期间获得的49个临床活检样本,对转移性肺癌进行了scRNA-seq测序分析。
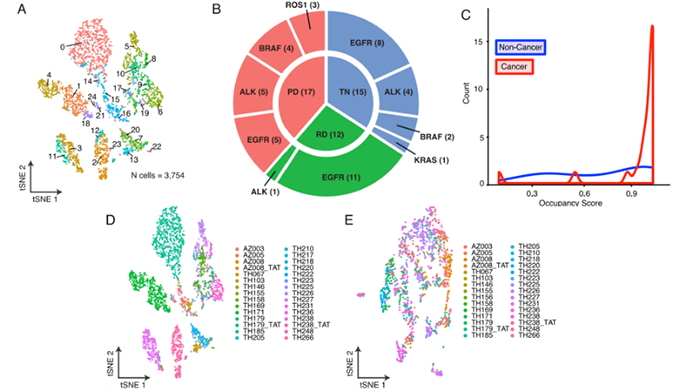
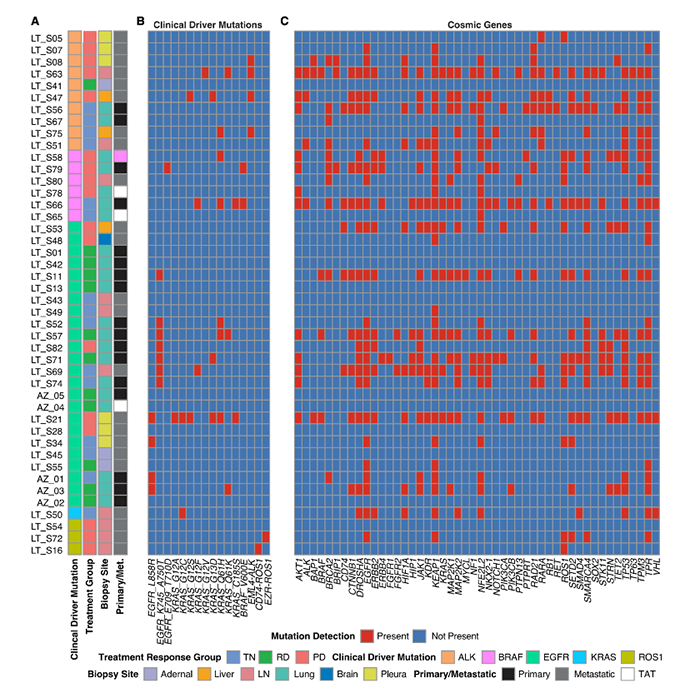
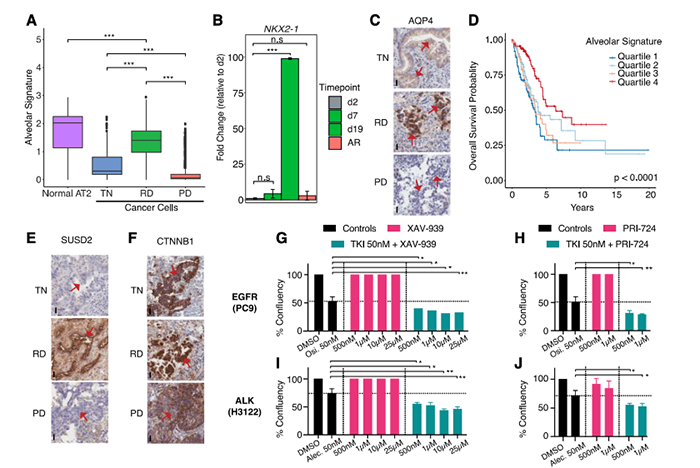
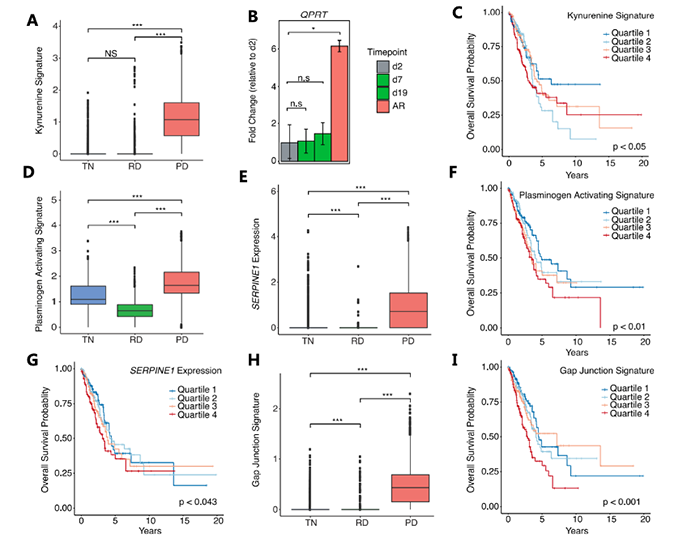
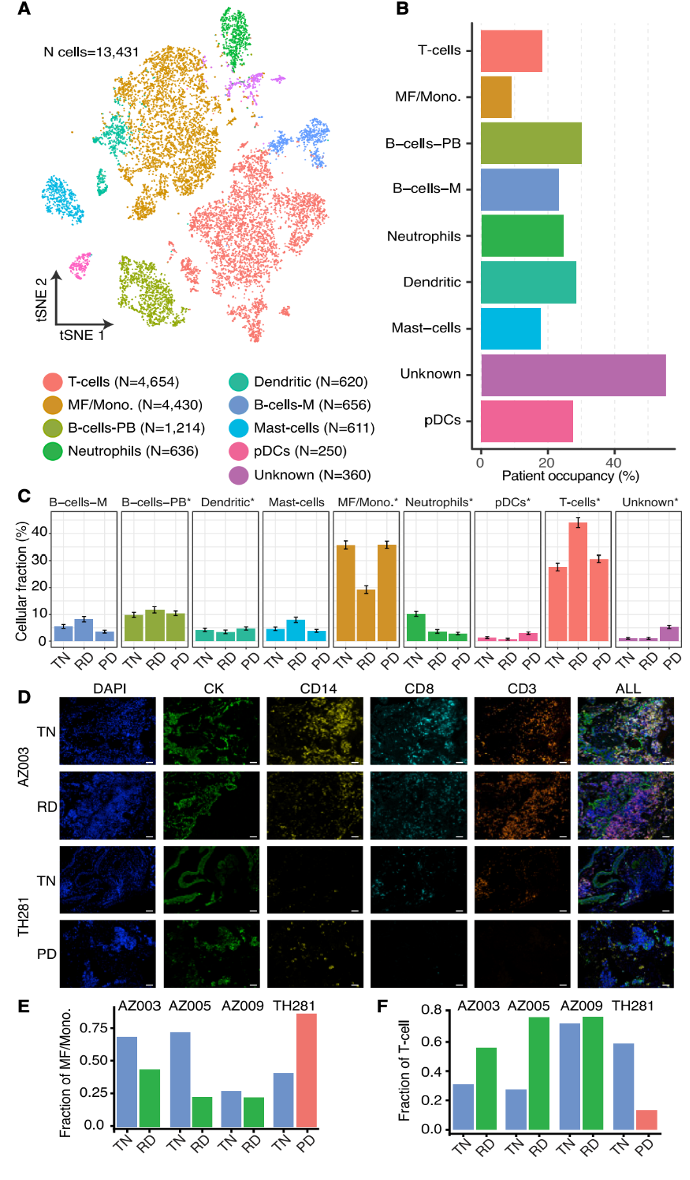
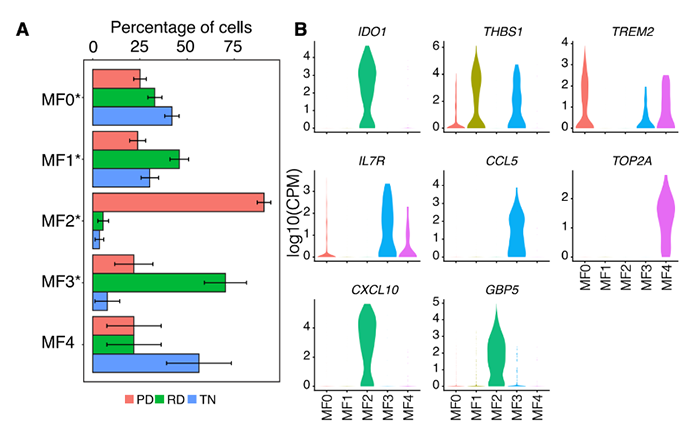
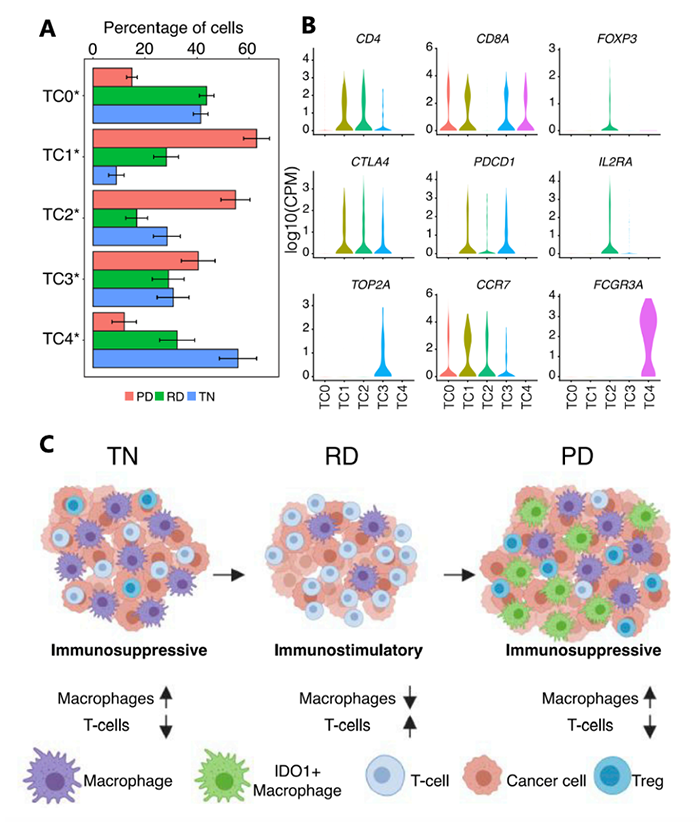
样本数据 样本信息:30个病人,49个样本(45个肺腺癌,1个鳞状细胞癌,以及3个肿瘤邻近组织 (TATs) ) 样本来源:主要从小型组织样本以及手术切除物中分离出的有活力的单细胞 样本分类:据是否接受靶向治疗及其治疗效果,样本被分为 (1) 未接受靶向治疗的样本 (TN) ; (2) 对靶向治疗后有响应的样本 (RD); (3) 经靶向治疗后获得性耐药的样本 (PD)。并按致癌驱动因素进一步细分。 实验方法 生信分析: 细胞分群、差异分析、富集分析、组成分析 生存分析、细胞亚分群、突变分析 验证生信结果的湿实验: RT-PCR、免疫组化 (immunohistochemistry,IHC)、多重免疫荧光 (Multiplex Immunofluorescence) 结 论 “ 拷贝数变异区分癌症与非癌症上皮细胞 质控后,23261个细胞被已知marker注释为免疫、基质(成纤维细胞、内皮细胞和黑色素细胞)或上皮细胞。上皮细胞(n = 5,581)被重新聚类为26个离散的上皮细胞集群。 鉴于癌症与大规模染色体改变之间的关联,作者利用拷贝数变异(CNV)从RNA表达中区分上皮细胞中的癌症和非癌症细胞;与成纤维细胞和内皮细胞(对照)相比,癌症细胞整个基因组的相对表达强度显示更大的变化(图1E),且癌细胞表达的独特基因数量增加了,而该差异不能用测序深度解释(Pearson相关性=0.19)。 图1.患者分类和癌症细胞的识别 癌细胞(n=3,754)重新聚类,产生了25个独特的群。大多数癌症细胞具有较高的患者占有率,非癌症细胞与之相反。 图2.癌细胞特点 “ 癌症细胞具有复杂的基因变异 44个含癌细胞样本中,20个携带了临床上已知的致癌驱动因素(图3B),11个(55%)包含临床上可操作的致癌基因,1个致癌改变在同一患者的肿瘤临床级bulk RNA检测中未发现(即隐性基因改变)(图3B)。 额外的基因改变可以与主致癌的''驱动''改变并存(如EGFR、ALK、KRAS)。Bulk DNA显示样本LTS47存在EML4-ALK的致癌基因重排,但scRNA-seq表明,该样本还含有KRAS G13D和KRAS G12C隐性突变。但无法断定ALK融合和KRAS突变是否在同一细胞内。为评估多种致癌性变异对患者的临床影响,作者对MSK-Impact NSCLC数据集进行了分析,结果表明在scRNA-seq检测到的,属于一级COSMIC变异的,大于或等于2个突变的患者,与突变少于2个的患者相比,总生存期(OS)明显较低。 对比COSMIC(Catalogue of Somatic Mutations In Cancer)肺腺癌一级突变发现,许多突变尽管已被纳入临床panel,但之前对肿瘤患者进行的临床级检测并未报告(图3C)。因此,基于临床级的bulk DNA检测可能低估了肿瘤的异质性。 图3.scRNA-seq推断患者的突变状态 “ RD癌细胞表达了肺泡再生细胞的特征 与TN相比,RD癌细胞中629个基因显著上调。与TN、PD相比,RD癌细胞表达的增殖类marker减少,此外,作者发现该类细胞表达一个由17个marker组成的肺泡细胞表达特征(图4A)。肺泡细胞负责气体交换、增值和再生。 该特征的激活被正交的方法验证。使用一个已被验证的由患者derived EGFR突变的NSCLCs,来模拟TN、RD和PD。RT-PCR表明,与TN、PD相比,NKX2-1(RD临床样本中上调的标志性肺泡细胞特征基因)在RD癌细胞中表达量明显增高(图4B)。免疫组织化学(IHC)分析表明了RD临床样本的质膜上AQP4蛋白(另一肺泡细胞特征标志物)的表达(图4C)。这表明,从scRNA-seq分析中发现的肺泡特征可在 in vitro 再现。 TCGA的肺腺瘤癌的生存分析表明,肺泡特征的高表达与患者的OS改善之间存在明显联系(图4D)。 RD队列中,WNT/β-catenin相关的通路基因SUSD2和CAV1的表达量增加,该结论可被IHC证明(图4E,F)。in vitro 研究证明前期抑制以上通路与同源TKI的结合会导致细胞汇合度显著的、剂量依赖性的下降,并增加了反应深度(图4G-4J)。 图4.差异分析、IHC表明RD癌细胞表达肺泡再生细胞的特征 “ PD过表达了犬尿喹啉通路、浆膜蛋白原和间隙连接蛋白 与TN和PD相比,PD癌细胞中有901个上调基因,与犬尿喹啉pathway相关的IDO1、KYNU和QPRT基因表达显著增加(图5A),使用PC9细胞 in vitro 模型中,QPRT也增加 (图5B)。这些基因可导致免疫抑制,因此,犬尿喹啉pathway可能可作为癌症进展的指标。TCGA肺腺癌的RNA-seq数据集表明,该特征的高表达量对应了更低的OS,进一步证明犬尿喹啉pathway与临床的相关性。 与PD相比,RD中过表达的基因与肺泡细胞特征、细胞生长、分化、细胞运动和肿瘤抑制相关。这表明,一个损伤修复和再生的细胞状态可能会促进癌细胞的惰性,并改善临床结果。 与之相反,PD癌细胞过表达了与侵袭、细胞间交流、分化和免疫调节有关的基因。如纤溶酶原激活途径相关基因(ANXA2、PLAT、PLAUR、PLAU)(图5D),浆膜蛋白酶原抑制剂SERPINE1(PAI1)(图5E)。浆膜蛋白酶原激活特征的高表达与患者OS恶化相关(图5F,图5G)。已知SERPINE1在一些癌症亚型中表达增加,并在细胞粘附、侵袭、肿瘤血管化、抗辐射和免疫抑制中发挥重要作用。以上结果揭示了浆膜蛋白酶原激活级联在靶向治疗中的潜在作用。此外,PD癌细胞中的几个间隙连接蛋白过表达(图5H)。该蛋白允许细胞间的离子、代谢物和次级信息的交换。 图5.与TN和PD相比,PD癌细胞的特征 “ PD过表达了鳞状细胞分化相关基因 同一患者的、同一原发肿瘤部位的、3个治疗时间点的活检样本发现了重叠的差异表达基因和标志物。与TN和RD相比,PD过表达了许多与鳞状细胞分化有关的基因 (KRT16, KRT14, KRT6A, KRT5, CLCA2, PKP1, ANXA8, DSG3)。患者在PD的肺部肿瘤活检确实显示出组织学上向鳞状细胞癌的转变,而之前的活检显示为纯腺癌组织学。因此,scRNA-seq可提供一个高分辨率的、基因和通路水平的、在癌症药物治疗期间产生的生物和组织学观点。 “ PD与RD的髓系、淋巴系免疫细胞分布相反 为探究治疗期间TME演变,免疫细胞(n = 13,431)被聚类并注解(图6A)。免疫细胞类型的集群显示出低病人占有率(图6B)。 所有的治疗时间点上,T细胞和巨噬细胞是主要的细胞群。与TN或PD样本相比,在RD的TME内,T细胞在所有免疫细胞中占较大比例,巨噬细胞与之相反(图6C)。在2名患者中,对不同治疗时间点获得的肿瘤活检的免疫细胞的分析证明了相同结论,且可被免疫荧光染色法验证(图6D-6F)。 TCGA数据表明,巨噬细胞比例高的样本,OS较差。这支持了临床意义,并与之前的报告一致,即巨噬细胞浸润与接受手术切除的早期NSCLCs患者的预后不佳有关,也与EGFR TKI治疗期间的无进展生存期更差有关。 图6.每种肿瘤内的肿瘤微环境组成的变化 “ 表达IDO1的巨噬细胞群富集在PD 巨噬细胞(n=1,379)被分为5个不同的亚群,这些亚群在三个处理组的富集程度不同(图7A)。MF2在PD中占比极高(图7A),表达促炎症细胞因子CXCL9, CXCL10和CXCL11(图7B),利于淋巴细胞被招募到TME。该群体中差异表达最大的基因还包括鸟苷酸结合家族蛋白GBP1和GBP5,它们在IFN-g激活的巨噬细胞中被诱导,并通过炎症体组装促进先天免疫系统内的炎症信号传递(图7B)。 尽管MF2内有促炎症基因的表达,但这组PD特异性巨噬细胞内差异表达最高的是IDO1(图7B)。IDO1由TME内的炎症诱导,并通过免疫抑制性骨髓细胞群、调节性T细胞(Treg)分化和免疫抑制性细胞因子环境促进耐受性环境。 图7.巨噬细胞亚群在每个治疗时间点表现出的独特的转录特征 “ 免疫抑制性T细胞表型在PD的TME中占主导地位 T细胞和NK细胞(n = 2,226)同样被分为5个不同的细胞亚群,并具有以下特点: • TC0:类似于naive-like CD8+的表型,表达CCR7、IL7R和SELL(图8B)。富集于TN。 • TC1:具有功能障碍或衰竭表型的T细胞群,表达抑制性受体PDCD1(编码为PD-1蛋白)和CTLA4。(图8B)。属于免疫抑制表型的T细胞富集在PD。 • TC2:由Treg细胞组成的(表达FOXP3、IL2RA、FOXP3、IL2RA)。属于免疫抑制表型的T细胞,富集在PD。 • TC3:增殖的肿瘤浸润性T细胞群。 • TC4:表达自然杀伤(NK)或自然杀伤性T细胞(NKT)标志物,包括NK (KIR2DL3, FCGR3A)以及中度表达的T细胞标志物(CD3,CD8)。富集于TN,在PD中表达较少。 图8.T细胞亚群在每个治疗时间点表现出的独特的转录特征 【参考文献】 Maynard, A., McCoach, C. E., Rotow, J. K., Harris, L., Haderk, F., Kerr, D. L., ... & Bivona, T. G. (2020). Therapy-induced evolution of human lung cancer revealed by single-cell RNA sequencing. Cell, 182(5), 1232-1251.