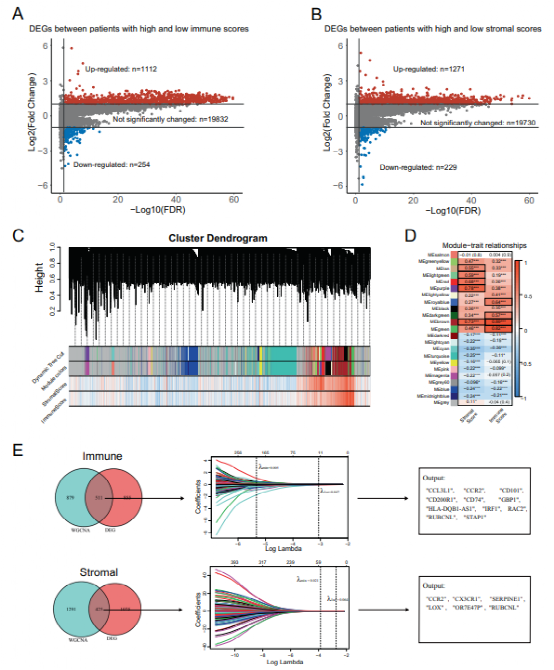
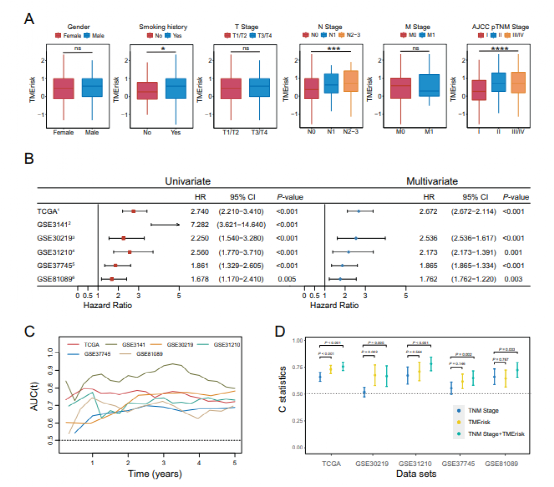
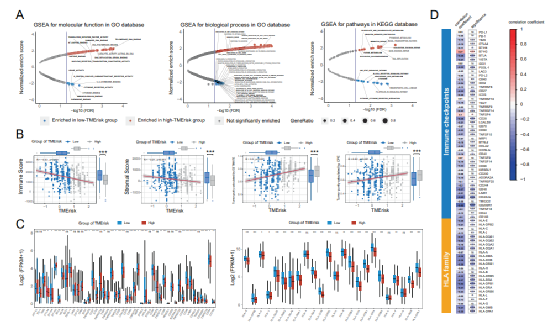
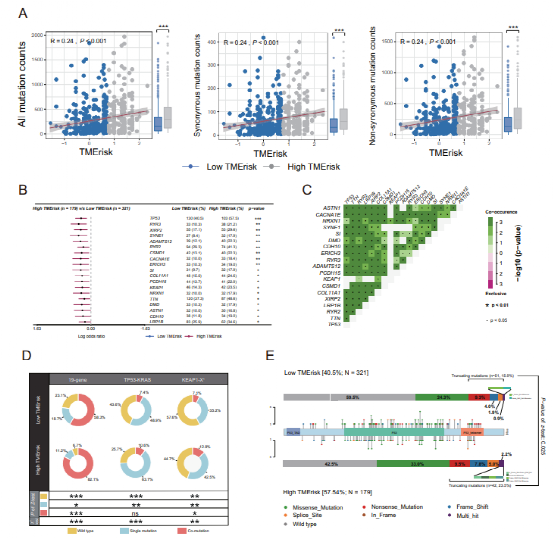
今天给大家解读一篇发表在Oncogene(IF:9.867)上的一篇基于肿瘤微环境开发的风险模型可预测肺腺癌患者的总生存期并与肿瘤免疫相关的文章。肺癌是全球癌症相关死亡的主要原因,腺癌是其主要病理类型,占40%以上。尽管治疗不断进展,肺腺癌(LUAD)的5年总生存率仍(OS)低于20%。肿瘤微环境(Tumor microenvironment, TME)是肿瘤所在的环境,由多种免疫细胞、基质细胞(包括间充质细胞、内皮细胞)、细胞外基质分子和多种细胞因子组成。TME已被报道在肺癌中发挥重要作用。1.免疫/基质评分的计算及其与患者临床特征的相关性作者将TCGA数据库中的510例LUAD患者纳入研究,计算免疫和基质评分。这些患者的基质评分范围为-1779.3~2106.9,免疫范围评分为-932.6~3449.2。免疫和基质评分在正常(邻近)/肿瘤组织、女性/男性患者、吸烟者/非吸烟者中具有显著的显著分布。较高的免疫评分与较低的T和美国联合委员会癌(AJCC) TNM分期,而较高的间质评分与较低的M分期相关。KM和Cox回归分析显示,免疫和基质评分较高的患者OS优于免疫和基质评分较低的患者。此外,通过CPE和ESTIMATE算法推断,免疫和基质评分与肿瘤纯度显著相关,具有很强的负相关性。在OS不同的组之间,火山图显示1366个差异表达基因(deg)与免疫评分相关,1500个deg与基质评分相关(Fig. 1A, B)。根据WGCNA的结果,我们识别出22个共表达基因模块(除基因未共表达的灰色模块外)(图1 c)。棕褐色、浅绿色、红色、紫色和棕色模块与基质评分有很强的相关性,而皇家蓝、深绿色、棕色和绿色模块与免疫评分有很强的相关性(图1D)。Venn图显示出deg的数量和它们的交点与强TME-correlated基因模块,这些基因进一步输入到LASSO-Cox回归分析中(图1E)。CCR2, CX3CR1, SERPINE1, LOX, OR7E47P和RUBCNL(也被命名为C13orf18)是从基质相关基因中选择出来的,而CCL3L1、CCR2、CD101(也被命名为Igsf2), cd200r1, cd74, gbp1, hla-dqb1-as1, irf1,RAC2、RUBCNL和STAP1是从免疫相关基因中选择的。Fig.1 Screening for TME-related genes.我们首先调查了TMErisk评分在不同性别、吸烟状况和TNM分期患者中的分布情况。我们发现有吸烟史和较高N或TNM分期的患者有较高的TMErisk得分(Fig. 2A)。单变量和多变量Cox回归分析检验TMErisk对预后影响的显著性。TMErisk得分越高,说明OS越差。调整年龄、性别、评分,吸烟史,放疗,药物治疗,还有TNM阶段后,TMErisk评分被确定为TCGA和四个GEO数据集中OS的独立危险因素(GSE30219, GSE30210, GSE37745, 和GSE81089,Fig.2B)。同时,时间依赖性的AUC提示TMErisk评分在TCGA和GEO数据集预测LUAD患者OS有相当大的价值(图2C)。如图2D所示,TMErisk在TCGA和GSE30219数据集的C指数显著高于TNM分期,在其他3个数据集的C指数相似。 Fig. 2 Evaluation and validation for the prognostic value of the TMErisk score.为了探索导致低TMErisk组和高TMErisk组结果不同的潜在机制,我们进行了GSEA,并注释了GO和KEGG富集分析。显著|富集分数(NES)|>1和FDR值< 0.05(图3A)。参与细胞周期、DNA修复、Wnt和NF-κB信号在高tmerisk组中富集,而与免疫细胞迁移和增殖、免疫应答、炎症反应、趋化因子和免疫应答相关的信号在高tmerisk组中富集JAK/STAT信号在低tmerisk组中富集。此外,高tmerisk组的免疫和基质评分显著降低,而肿瘤纯度较高(图3B)。我们还研究了24个HLA家族基因和48个免疫检查点在高tmerisk组和低tmerisk组之间的基因表达。根据Wilcoxon检验,在高tmerisk组中,有20个HLA家族基因和33个免疫检查点被显著调节(图3 c)。我们的分析还显示,TMErisk评分(作为一个连续变量)与16个HLA基因和28个免疫检查点(包括HLA- dra、CTLA-4、BTLA、B7-H3和VISTA)的表达显著相关(图3 c)。浸润性免疫细胞的分布由TIMER, CIBERSORT,和xCell在低和高tmerisk组之间也被调查(图4)。Fig.3 Function enrichment analysis for TMErisk and correlation between TMErisk and expression of the HLA family genes/immune checkpoints.Fig. 4 Landscape of immune and stromal cell infifiltrations in the low- and high-TMErisk groups.5.高tmerisk组和低tmerisk组LUAD患者的突变状态为了研究LUAD中tmerisk的相关机制,我们还分析了TCGA数据库中的体细胞突变。当比较低tmerisk组和高tmerisk组之间的突变频率时,在高tmerisk组观察到更多的体细胞突变,包括非同义突变和同义突变(图5A)。同时,MAFTOOLS分析结果显示TME高危组LUAD患者中有19个基因突变频率较高(Fig. 5B)。此外,在这些基因的突变中观察到显著的共现现象(图5C)。有趣的是,KEAP1、KRAS、STK11、PBRM1和SMARCA4表明对免疫治疗的反应更差,在高tmerisk组(55.3%)显著高于低tmerisk组(42.3%) (P < 0.05,图5D)。同时,我们在高tmerisk组中观察到更多的TP53截断突变(23.5%)高于低tmerisk (15.9%) (P < 0.05,图5E)。Fig. 5 TMErisk was related to tumor mutation status.在本研究中,作者开发了一个基于免疫和间质评分的风险评分系统(TMErisk),并对其性能进行了验证。作者的结果表明,TME风险是一个独立的预后因素,对LUAD患者的OS有相当大的预测作用。从功能上讲,TMErisk评分与LUAD患者的免疫应答相关。在验证数据集上的表现表明了它广阔的利用前景。