作者:刘小泽
文章信息
题目:Using single-cell sequencing technology to detect circulating tumor cells in solid tumors
日期:2021-08-19
期刊:Mol Cancer
链接:https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-021-01392-w

介绍
循环肿瘤细胞(CTCs)是起源于上皮来源的原发性或转移性肿瘤并脱落到血液循环系统中的具有高活力和高转移潜能的肿瘤细胞。CTC 是液体活检的重要组成部分之一,为实时监测肿瘤进展提供了一个方法。
一般来说,肿瘤组织的高通量测序分析是基于对数百万个细胞的混合样本的分析,它反映了细胞的整体基因组特征,但忽略了肿瘤细胞的异质性,容易忽略 CTC 和癌症干细胞 (CSC) 以及其他低丰度但功能重要的细胞。单细胞测序技术的出现很好地解决了这个问题。CTCs单细胞测序可用于比较外周血CTCs、肿瘤原发灶和转移灶、转移淋巴结中单细胞基因组、转录组和表观遗传组的差异,减少肿瘤异质性的干扰。单细胞测序为了解肿瘤发生和发展的生物学过程提供了新的视角,并已应用于乳腺癌、结直肠癌、恶性黑色素瘤、肺癌和前列腺癌等肿瘤研究 。本文回顾了使用单细胞测序技术分析实体瘤外周血中 CTC 基因组变异的研究进展。
肿瘤异质性和单细胞测序分析
肿瘤异质性是指肿瘤经过多次分裂增殖后,在生长过程中出现的子细胞基因组、蛋白质组和基因表达的差异;这些差异可以导致表型和特征的差异,例如生长速度、侵袭能力、药物敏感性和预后。异质性是恶性肿瘤的特征。肿瘤异质性可以让肿瘤细胞适应肿瘤微环境的变化,促进肿瘤抵抗和进展。
一般来说,肿瘤异质性包括两种类型:
肿瘤间异质性,由不同肿瘤细胞之间的基因和表型差异组成。肿瘤之间的异质性源于肿瘤细胞对基因组和表观遗传修饰的反应不同以及源自不同肿瘤分层的不同肿瘤细胞亚群引起的不同肿瘤表型。此外,肿瘤间质异质性也与肿瘤微环境中细胞和细胞外基质的异常调控有关。例如,肿瘤间质含有不同的肿瘤相关成纤维细胞、巨噬细胞和肿瘤浸润淋巴细胞。这些因素都在肿瘤的恶变中起重要作用 肿瘤内异质性:指同一肿瘤中存在不同的癌细胞亚群,由肿瘤内不同细胞之间的基因和表型差异组成;肿瘤内部的异质性使肿瘤细胞既具有时间异质性(原发性肿瘤与继发性肿瘤不同),也具有空间异质性(同一肿瘤不同区域不同)。目前认为肿瘤异质性与基因突变的随机性和环境因素的异质性及其影响有关。
原发性肿瘤、转移性淋巴结、转移灶和不同的转移灶存在多层次的异质性,包括基因组变异、RNA转录和蛋白质表达谱。2012 年,Vermaat 等人使用定制的“Cancer Mini-Genome”芯片对原发性结直肠癌和肝转移样本中肿瘤相关信号通路中的1264个基因的外显子组进行测序。结果表明,在原发肿瘤中影响蛋白质功能的变异数量远多于肝转移,揭示了结直肠癌原发灶与其肝转移灶之间的基因组差异很大。Colombino 等比较了恶性黑色素瘤患者原发和转移淋巴结的突变情况,以及脑和皮肤转移灶的 BRAF、NRAS 和 p16CDKN2A 突变,发现转移淋巴结与原发淋巴结更相似淋巴结多于脑和皮肤转移。
循环肿瘤细胞
CTCs是实体瘤患者外周血中具有高活性和高转移潜能的一组肿瘤细胞。CTCs是肿瘤液体活检中重要的肿瘤标志物之一。CTC 的数量及其表型都与原发性肿瘤的进展有关。观察和分析 CTCs 的数量和表型可以间接揭示肿瘤病变的性质。CTC 可用于通过外周血分析监测肿瘤进展的观点已得到广泛认可。但由于外周血中 CTC 的丰度相对于血细胞数量较低,因此很难将它们与其他血细胞区分开来。
循环肿瘤细胞的富集和鉴定
CTC富集技术主要包括基于细胞表面标志物的富集技术和基于微流控芯片的富集技术。
基于细胞表面标志物的富集:主要包括正选择和负选择,即抗上皮细胞粘附分子(EpCAM)和角蛋白(cytokeratin,CK)等抗体捕获和富集上皮来源的肿瘤细胞和/或利用白细胞-衍生抗体以去除白细胞。例如,FDA 批准了使用 EpCAM 和 CD45 抗体从血液中捕获 EpCAM + 细胞的细胞搜索富集方法,用于乳腺癌和前列腺癌患者的 CTC 检测。 基于微流控芯片:根据CTCs的生物学和物理特性,分离肿瘤患者的外周血单个核细胞(PBMCs),在稳定缓慢的层流控制下通过EpCAM抗体包被的微流控芯片,EpCAM+细胞被EpCAM抗体捕获。并与芯片底部结合,而剩余的淋巴细胞则随液体流出,如 CTCs-i 芯片方法。
CTC 鉴定主要通过免疫荧光、荧光原位杂交 (FISH) 和 RT-PCR 分析进行。先前研究中鉴定的分离的外周血有核细胞通过免疫荧光染色、染色体非整倍性变化和特定的肿瘤相关基因突变显示出 EpCAM + 、CK + 和 CD45- 表型等特征。这些细胞被鉴定为源自上皮细胞的 CTC
循环肿瘤细胞的主要生物学特性
外周血 CTC 也是异质肿瘤细胞。来自不同肿瘤的 CTC 的表面标志物各不相同,细胞大小也不同,可以表现为单细胞或簇状。与更具攻击性但更脆弱的 CTC 相比,相对良性的 CTC 具有复制率增加的优势。
研究表明,外周血中 CTC 的出现是上皮来源实体瘤形成的早期事件;外周血中的 CTC 可以同时或双向刺激原发性和转移性肿瘤中肿瘤细胞的生长。
单细胞分选和测序分析
分选
传统的单细胞分选方法,如荧光激活细胞分选 (FACS),不适用于 CTC 单细胞分选。用于CTC单细胞分选的方法主要有显微操作分选法、微流控技术分选法、DEPArray和Cell Celector分选系统
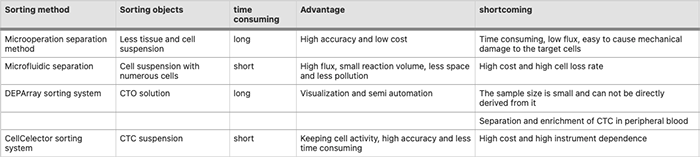
微量移液器分离(micropipette isolation)涉及使用微机械机械手或视觉镊子完成单细胞分选的高倍显微镜,优点是可以有效控制靶细胞的选择、转移和释放,以低成本保证细胞选择的准确性,但这种方法耗时长,通量低,容易对靶细胞造成机械损伤。适用于分离在整个细胞群中数量较少的靶细胞,可用于通过 Cell Search 或 Mag Sweeper 技术进行富集以分选有核细胞 微流控分选方法(microfluidics)可与下游基因组扩增技术相结合,一步完成单细胞分选、裂解、扩增,如Fluidigm的C1单细胞放大器,具有高通量(每个芯片可完成96个单细胞扩增)细胞分选),反应体积小(可提高扩增效率,减少试剂消耗),污染少,对测序影响小。缺点是粘性和非球形细胞的捕获率低,芯片成本高 DEPArray 分选系统(Di-Electro-Phoretic Array 系统)是指一种半自动分选系统,可将稀有细胞从混合细胞群中分离出来。缺点是耗时长,样品体积小(仅14 μL)。这种方法已在单细胞水平上用于研究乳腺癌和结直肠癌中的 CTC Cell celector 分选系统是一种自动分选系统,可将稀有细胞从混合细胞群中分离出来。通过多功能机器人系统自动检索单细胞和细胞克隆,实现单细胞分选,直接机械分离目标细胞或克隆,不影响细胞活力,实时、高精度观察细胞图像进行细胞分选;但是,这种方法很耗时
单细胞全基因组扩增
单个细胞的DNA含量仅为6~7 pg,达不到全基因组测序所需的DNA含量水平。单细胞全基因组测序需要高保真、高效、无偏的基因组扩增。全基因组扩增(WGA)的发展推动了单细胞基因组测序技术的进步。
在PCR扩增方法的基础上,即改进传统PCR的特异性引物或随机引物的PCR扩增方法,如引物-接头PCR(LA-PCR)、引物延伸预扩增PCR、PEP-PCR和简并寡核苷酸引物PCR(简并寡核苷酸去引物PCR,DOP-PCR)。
此外还有:
多重置换扩增(MDA):以随机六聚体为引物,连续合成合成能力强、保真度高、链置换活性强的φ29 DNA聚合酶,在30℃下完成扩增 多重退火和基于循环的扩增循环 (MALBAC) :一种线性扩增方法,由于所用 Taq DNA 聚合酶保真度低,该方法检测 SNV 的假阳性率较高(约为 MDA 的 40 倍) 转座子插入线性扩增(LIANTI):引入了一个特殊设计的Tn5转座子,该方法的覆盖率和均一性提高,等位基因缺失率和假阳性率降低
单细胞全基因组测序
首先检测扩增产物总量和片段分布,构建合格样本库 测序数据分析的基本过程与NGS相似:原始数据过滤质控,然后比对参考基因组。目前针对单细胞测序开发的数据分析方法有Smash Cell、Velvet-SC、SPAdes等
单细胞基因组测序可以提供有关大规模基因组结构变异的信息,包括基因组重排、插入、复制、倒位和转座,以及基因组结构变异信息,例如 CNV 和 SNV。SNV 包括单碱基插入、缺失和突变。通过这些基因组结构变异,可以发现肿瘤驱动基因和生物标志物,也可以了解肿瘤发生的进程。
循环肿瘤细胞的单细胞测序
作为肿瘤进展的重要指标,对实体瘤患者外周血进行CTC单细胞全基因组测序分析有助于了解肿瘤的发生、发展,尤其是肿瘤异质性和耐药性,并能识别肿瘤发生机制发展。发现基因突变可以导致发现新的驱动基因,增强对肿瘤克隆起源和进化机制的理解,识别肿瘤亚型之间的基因序列差异,并有助于发现新的生物标志物。
新兴的重要 CTCS 单细胞测序技术,例如 Hydro-Seq 和 EISOT & EPIDROP 检测。其中Hydro-Seq利用基于大小的单细胞捕获来防止可能由分子 CTC 选择导致的偏差,实现了高细胞捕获效率,用于分析 10 ml 血液样本中的少量 CTC。Hydro-Seq 提供了通过单细胞全转录组测序分析 CTC 的能力,用于转移研究和伴随诊断应用
CTC分析促进肿瘤的准确分型
之前的许多研究使用 Sanger 测序或 NGS 方法在单细胞水平检测 CTC 中的特定基因突变,并发现肿瘤患者与同一肿瘤患者之间存在异质性。例如,在结直肠癌研究中,发现了不同 CTC 中的 BRAF、PIK3CA 和 KRAS 突变,表明个体之间和同一个体内部都存在大量肿瘤异质性;在恶性黑色素瘤中, BRAF 和 KIT 突变的测序揭示了 CTC 和肿瘤组织之间的高度异质性。
通过全基因组测序和比较基因组杂交(阵列比较基因组杂交,aCGH)技术,可以在全基因组水平上研究CTC中的CNV变异模式。一项针对多种肿瘤(包括胃癌、结直肠癌、乳腺癌和肺癌)的 CTC 单细胞全基因组测序研究表明,同一患者的不同 CTC 具有高度一致的全基因组 CNV 变化模式,而 CTC CNV不同肿瘤、不同病理类型的变异模式差异较大。
CTC分析可揭示肿瘤转移机制
肿瘤的复发和转移是肿瘤死亡的主要原因。CNV等突变模式的CTC单细胞测序分析有助于了解肿瘤转移的机制。
有研究(https://pubmed.ncbi.nlm.nih.gov/24752078/)选取了 10 名外周血中未检测到 CTC 的转移性前列腺癌患者,对原发性肿瘤和转移性肿瘤的组织样本进行外显子组测序分析。在主要病灶中发现了 10 个突变,称为“早期突变”,在转移病灶中发现了 56 个突变,称为“转移性突变”。然后,又选择了两名外周血中含有超过 20 个 CTC 的转移性前列腺癌患者。对原发肿瘤、转移灶和CTC单细胞进行外显子组测序分析,发现其中9个CTC与原发肿瘤相关。在病灶中发现了相同的“早期突变”,在 CTC 中发现了 41 个“转移性突变”,表明 CTCs 包含原发肿瘤和转移基因突变信息;因此,有可能从 CTC 中发现的突变确定肿瘤转移的机制
文章来源:单细胞天地













