铁死亡(Ferroptosis)是一种铁离子依赖性的,脂质过氧化驱动的特殊细胞程序性死亡形式,十年前被确定为一种独特的现象并命名。铁死亡涉及广泛的生物学背景,在发育,衰老,免疫,肿瘤等众多生理病理过程均发挥重要作用。
作为一种全新的细胞死亡方式,从2012年初次被Brent R.Stockwell实验室正式定义到现在,PubMed关于「铁死亡」相关文章快速增多,2021年达1700篇。

2012年5月25日,铁死亡见刊
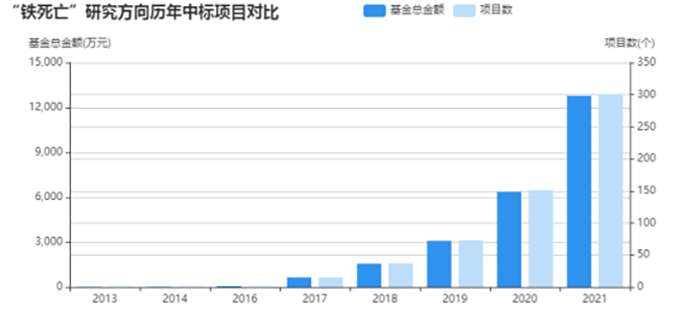
国自然项目中「铁死亡」的中标项目也是逐年飙升。2021年铁死亡相关课题中标近300项,在2020年基础上翻倍。
今天小编通过解读2篇综述,带大家了解铁死亡的机制及其在疾病治疗中的应用。(具体内容可详读原文,文中有综述下载链接)
综述一: 2022年7月7日,顶级铁死亡专家Brent R. Stockwell教授(铁死亡概念的提出者和铁死亡机制的主要贡献者)在Cell杂志在线发表了一篇重磅综述。该综述从新陈代谢、活性氧生物学和铁生物学等方面系统阐述了铁死亡的关键调控因子,重点介绍了铁死亡领域的关键概念和主要未解问题。 (原文下载:https://www.cell.com/action/showPdf?pii=S0092-8674%2822%2900708-5) 综述二: 2022年2月8日浙江大学生命科学研究所的张龙等发表于Cancer Communications上的综述,详细解读了铁死亡中脂质过氧化导致细胞死亡的特征和原因,总结了铁死亡的三大代谢规律及其与经典信号通路。 (原文下载:https://onlinelibrary.wiley.com/doi/epdf/10.1002/cac2.12250)

铁死亡代谢途径
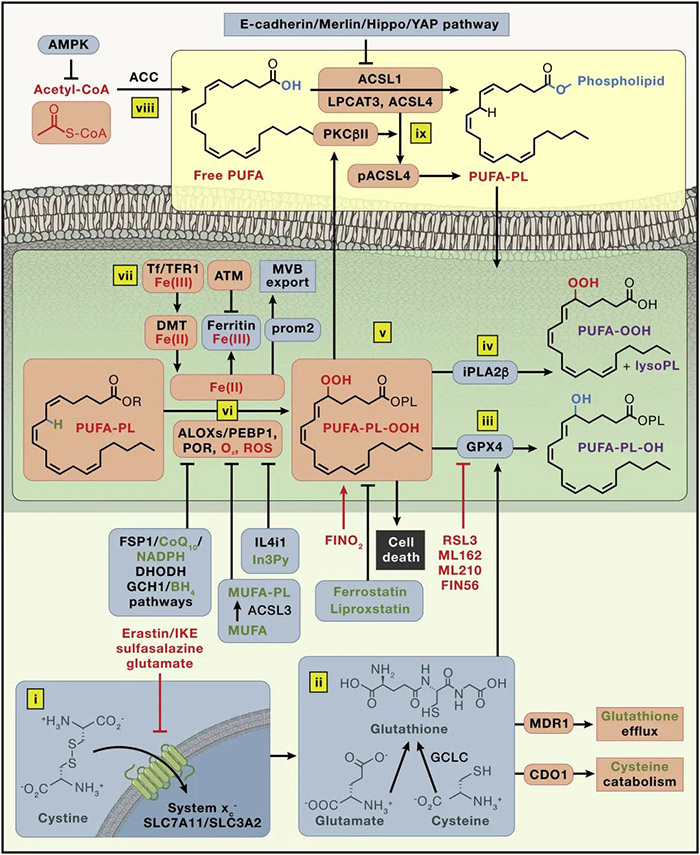
铁死亡是由于ROS的积累导致脂质过氧化引起的,ROS的积累超过了谷胱甘肽 (GSH) 和谷胱甘肽过氧化物酶4(GPX4)的氧化还原含量。
铁、脂质和活性氧在细胞存活中发挥着不可替代的作用。然而,过度依赖是一把双刃剑,这三者在稳定状态下维持正常的身体功能,并在发生代谢紊乱时对细胞造成致命打击。
铁死亡涉及的复杂生物过程是由抗氧化剂、铁和脂质动力学的不平衡引起的。
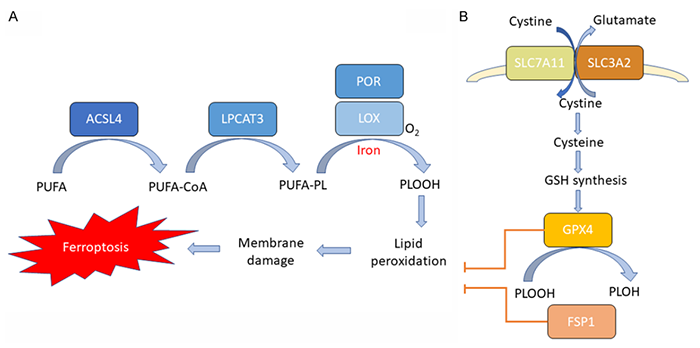
01 脂质代谢:特定脂质成分的过氧化是铁死亡的核心驱动机制。
多不饱和脂肪酸(PUFA)的相邻羰基间碳原子的C-H键相对更容易受到氧自由基的攻击,形成过氧化的状态(PUFA-OOH)。但一些实验表明,游离的PUFA并不触发铁死亡,只有存在于磷脂(PLs)等脂质物质上的PUFA(PUFA-PL)被过氧化后(PUFA-PL-OOH)才能激活铁死亡机制。
细胞膜富含含有多不饱和脂肪酸(PUFA)的磷脂(PLs),极易受到ROS诱导的过氧化作用的影响。脂质过氧化导致脂质双层的破坏和膜的损伤,随后导致细胞死亡。
多不饱和脂肪酸需要合成、活化并整合到膜PLs中才能参与这一致死过程,这需要两种关键酶,酰基辅酶A合成酶长链家族成员4(ACSL4)和溶血磷脂酰胆碱酰基转移酶3(LPCAT3)。ACSL4能够催化长链多不饱和脂肪酸与辅酶A(CoA)的连接,LPCAT3促进这些产物的酯化和并入膜磷脂。
除了ACSL家族和LPCAT3基因,最近报道iPLA2β也参与铁死亡调控,iPLA2β可催化过氧化的PUFA从磷脂分子中去除,最终抑制p53介导的铁死亡过程。
脂质组学研究表明,与其他磷脂类型相比,携带至少一个花生四烯酸或者肾上腺酸脂肪链的磷脂酰乙醇胺与铁死亡的相关性更强。
02 铁代谢:铁离子是铁死亡发生的重要因素。
作为“生物元素”之一,富氧环境中的铁可以通过与不同类型的磷脂氢过氧化物和脂质(脂肪酸)氢过氧化物的芬顿反应(Fenton)产生ROS。
铁离子调控PUFA-PL过氧化有两种机制:一方面不稳定铁离子池可介导Fenton反应;另一方面,介导脂质过氧化的一些酶需要亚铁离子(二价铁)作为辅因子。
03 抗氧化代谢:胞内ROS是触发铁死亡的重要机制。
在正常情况下,铁介导的脂质氧化受到细胞抗氧化防御系统的严格控制。谷胱甘肽过氧化物酶4(GPX4)被认为是关键的抗氧化酶,直接作用于消除脂质双层中的氢过氧化物并防止致命脂质ROS的积累。
除了GPX4通路,目前还有另外三种机制参与铁死亡调控:FSP1/CoQ10/NADPH途径,DHODH途径以及GCH1/BH4途径。最近报道IL4i1也具有抑制铁死亡的作用,是新的潜在铁死亡调控。
这些通路机制都是通过调控GSH,CoQ10等胞内还原力,进而调控ROS含量来调控脂质过氧化和铁死亡的。
铁死亡机制
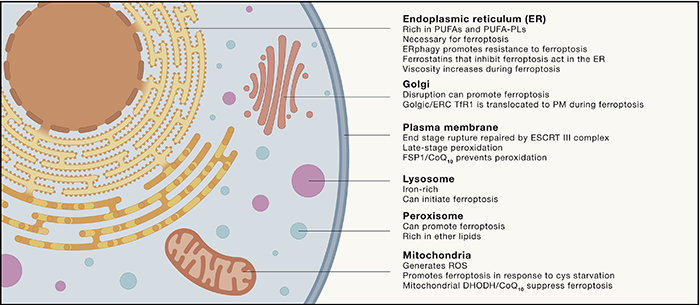
细胞器与铁死亡
细胞器在铁死亡中扮演了特殊的角色,主要包括:
细胞质膜:质膜破裂是铁死亡的晚期事件; 内质网:内质网含有丰富的PUFA-PL,是脂质过氧化发生的主要场所;ERPhage(细胞自噬的一种类型)可介导铁死亡耐受。 线粒体:线粒体是代谢的主要场所,可产生大量ROS,在铁死亡过程中主要在早期发挥作用,在半胱氨酸(Cys)饥饿或GSH剥夺条件下会放大铁死亡信号。 过氧化物酶体:缩醛磷脂(plasmalogens)是铁死亡的驱动因素之一。过氧化物酶体内的过氧化氢可能具有促进脂质过氧化的作用. 溶酶体:重要的铁离子存储位置,在铁死亡起始阶段发挥作用。 高尔基体:细胞发生铁死亡的时候 转铁蛋白受体1(TFR1)会转移至细胞质膜上;Golgi stress可诱导铁死亡。
总之,内质网是铁死亡发生的主要场所,线粒体,高尔基体,过氧化物酶体和溶酶体在铁死亡发生的不同阶段有不同的作用。
在疾病治疗中的应用
铁死亡与众多的人类疾病发生发展密切相关,包括铁过载病,器官损伤,视网膜变性,多种神经退行性疾病【阿尔茨海默氏症(Alzheimer’s disease, AD)、帕金森氏症 (Parkinson’s disease, PD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis, ALS)和亨廷顿病(Huntington’s disease, HD)等】,感染性疾病,自身免疫疾病以及肿瘤等等。
研究表明许多癌症相关基因和信号通路都能调控铁死亡,诱导癌细胞铁死亡对治疗癌症意义重大。
对凋亡和常规癌症疗法抵抗的间充质干细胞和去分化的癌细胞,以及被称为“持续细胞”的癌细胞都对铁死亡诱导高度敏感。与正常细胞相比,癌细胞代谢比较旺盛,线粒体出现功能障碍,ROS积累较多,增加了癌细胞对铁死亡的敏感性。
铁死亡已被确定为非小细胞肺癌、乳腺癌、胰腺癌、肝细胞癌和其他致肿瘤细胞死亡的原因。因此,靶向诱导铁死亡可能是一种新的癌症治疗策略。下图为铁死亡的经典癌症及相应的治疗药物,以及铁死亡疗法中治疗癌症的的小分子。
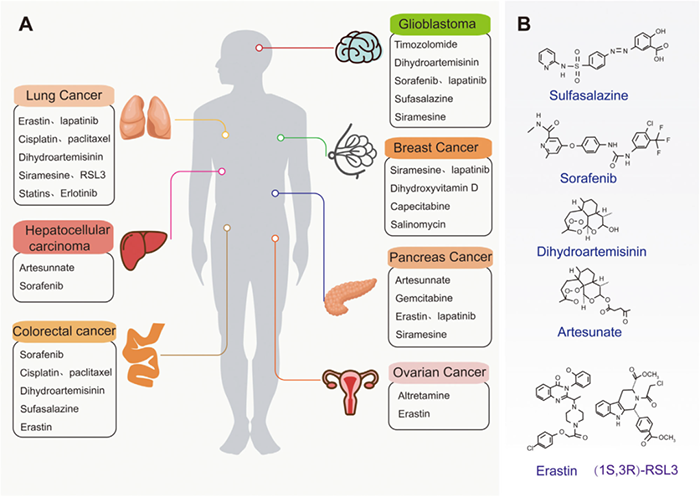
与铁死亡相关的药物主要通过以下方式发挥其临床功能:(1)通过调节抗氧化剂抑制XC-谷胱甘肽/GPX4轴;(2)调节p62-Keap1-NRF2通路和NRF2的下游抗氧化基因表达;(3)通过调节溶酶体、铁蛋白、转铁蛋白和铁自噬体的功能激活铁轴引发铁死亡。
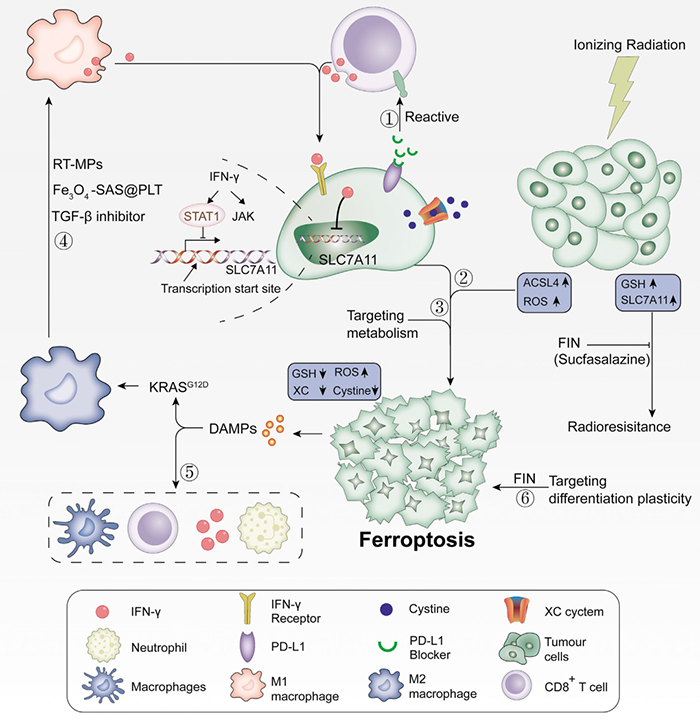
另外,铁死亡被认为与T细胞介导的抗肿瘤免疫有关,并影响肿瘤免疫治疗的效果。铁死亡六种潜在的治疗癌症的方法:(1)铁蛋白酶和肿瘤免疫检查点抑制剂治疗的结合;(2)利用铁蛋白酶激活肿瘤免疫细胞,逆转对放疗的抵抗;(3)针对肿瘤代谢特征,特异性诱导铁蛋白酶;(4)利用铁蛋白酶诱导抗癌巨噬细胞的先天转化;(5)诱导损伤相关分子模式的产生和(6)针对癌细胞分化的可塑性。
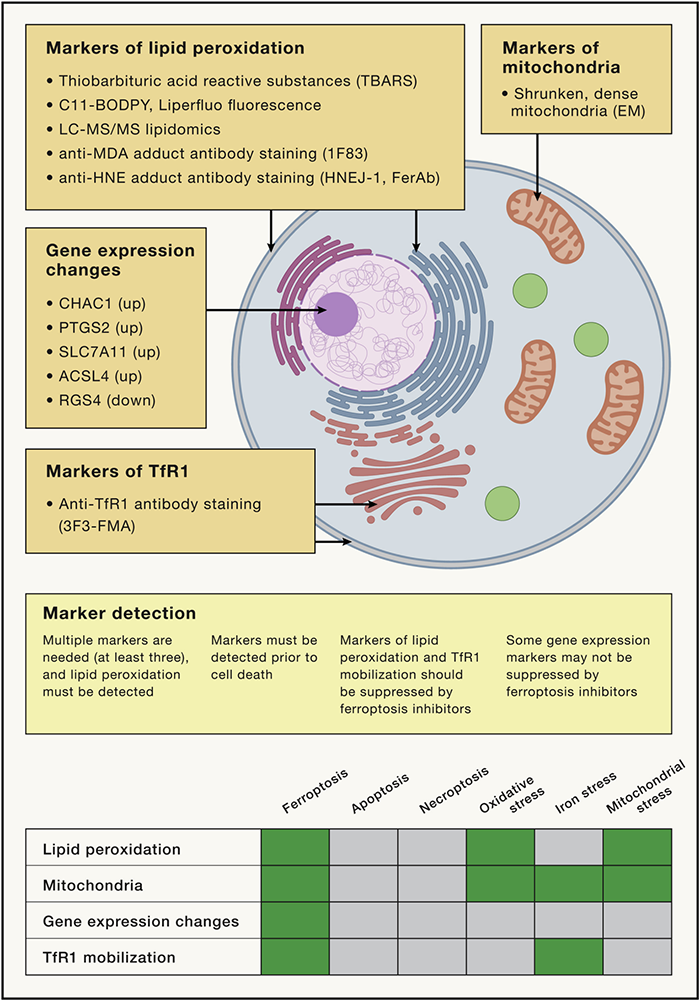
铁死亡检测的标志物
铁死亡是与细胞凋亡,坏死等不同的细胞死亡机制,有特有的标志性特征和基因。鉴定铁死亡所需的主要标志物和基因,包括:
鉴定是否发生铁死亡的标准:上述Marker至少需要做三种以上的Marker的检测(这些Marker需要在细胞发生死亡之前进行检测);脂质过氧化必须要检测
铁死亡标志物
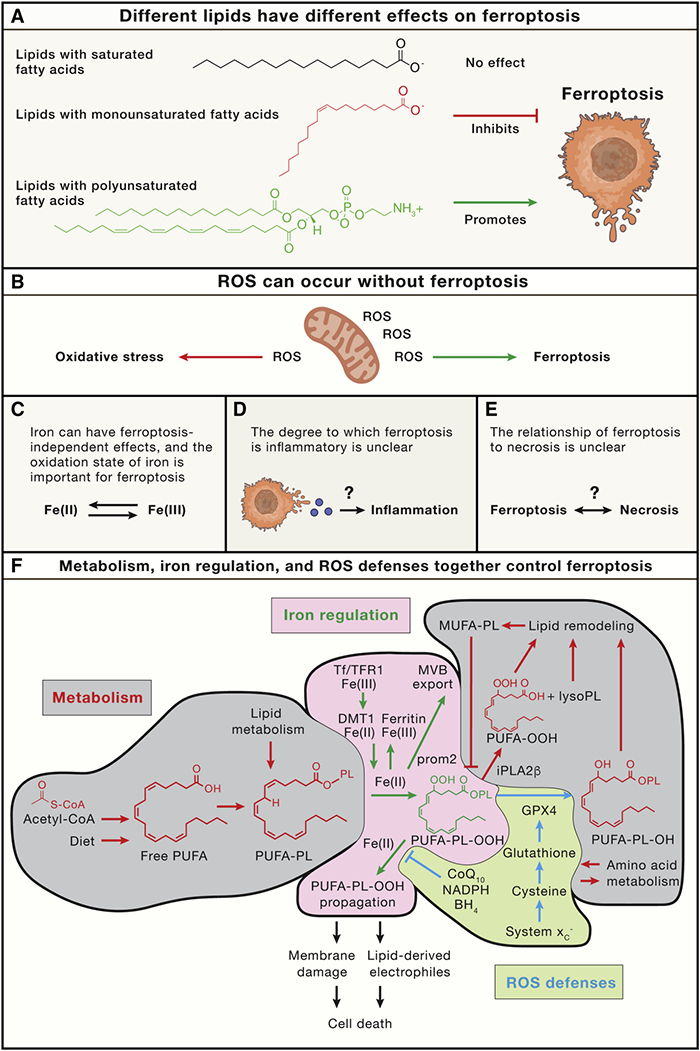
目前关于铁死亡的研究越来越多,但关于所观察的现象是否属于铁死亡,存在很多的分歧,为此,Brent R.Stockwell在综述中,对铁死亡六个方面的问题做了重申: (1)不同的脂质发生过氧化后对铁死亡的效应不同。不同脂质成分对铁死亡的效应不同,但不饱和脂肪酸对铁死亡还有抑制作用,具体的依然处于不断研究中。 (2)铁死亡不等同于ROS累积。ROS是铁死亡发生的重要因素之一,但不意味着检测到ROS升高就等同于发生了铁死亡过程。 (3)铁的积累并不等同于铁死亡,铁的氧化状态对于其促进铁死亡非常重要:二价铁在铁死亡中发挥作用,而三价铁主要结合在Ferritin中,是惰性的。因此铁离子的检测还要注意它们的氧化还原状态。 (4)铁死亡是否属于特殊的细胞坏死机制还没有定论。 (5)铁死亡在不同情况下具有炎症性和/或免疫原性的程度仍不确定。 (6)铁死亡是受到代谢,ROS和铁离子共同调控,因此,扰乱代谢、铁稳态和ROS水平是调节细胞对铁死亡感性的关键手段。
(1)铁死亡的基本机制是什么? (2)探索诱导铁死亡的的不同触发因素将有助于阐明铁死亡在生理和病理过程中激活的机制和条件。 (3)条件性控制铁死亡的技术还有待进一步开发:在特定组织、细胞和/或疾病环境中的选择性激活或抑制,对于将铁死亡的知识转化为治疗方法可能是至关重要的。目前尚未解决的重要问题
来源:中洪博元生物













