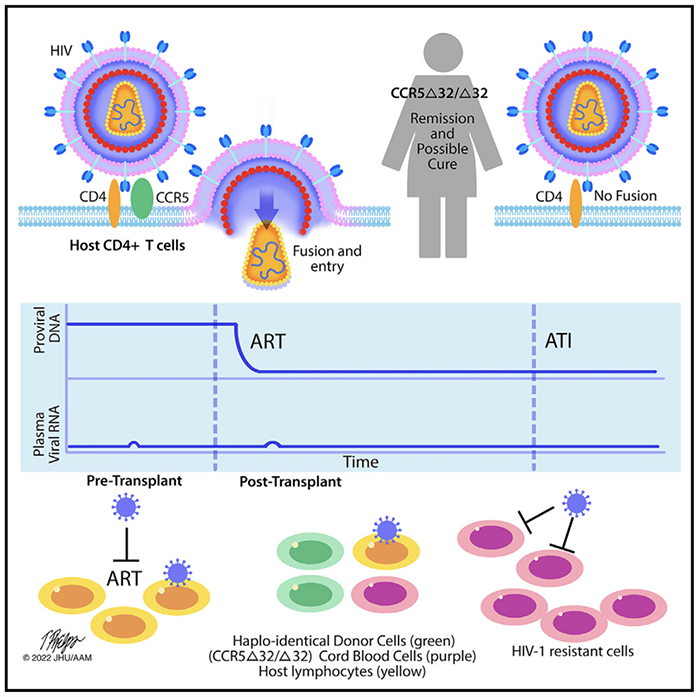
世界范围内有约3800万人类免疫缺陷病毒(HIV)携带者,HIV-1病毒会潜伏在长寿的静息态记忆CD4+ T细胞上, HIV患者需要接受抗逆转录病毒治疗(ART)来降低体内的病毒载量,但是当ART停止后,这些潜伏在T细胞中的HIV前病毒会造成病毒血症,到目前为止,HIV仍然不能完全治愈。趋化因子受体5 (CCR5)是HIV-1感染CD4+ T细胞的主要受体,纯合CCR5 32(缺失32对碱基)移码突变导致细胞表面不表达CCR5,从而使得携带该纯合突变的人对HIV具有自然抗性【1-6】。在北欧高加索人中,大约有10%的人携带该突变,但是只有1%的人是纯合突变【7】。人们后来发现,移植CCR5 32/32干细胞可以将受体的免疫系统替换成对HIV具有抗性的免疫系统,最终产生HIV”豁免“和治愈。目前已有4例已发表的通过CCR5 32/32干细胞移植的HIV治愈病例,即”柏林病人“、”伦敦病人”、“杜鲁塞尔多夫病人”和“希望之城病人”【8-12】。2023年3月16日,来自美国威尔康奈尔医学院/纽约长老会医院的Jingmei Hsu研究团队在Cell上发表题为HIV-1 remission and possible cure in a woman after haplo-cord blood transplant 的文章,报道了第一例女性HIV“豁免”和可能治愈的病例。为了治疗急性髓系白血病,该患者接受了CCR5 32/32脐带血细胞结合单倍体相合的干细胞移植,移植后14周时外周血已经100%来源于CCR5 32/32脐带血细胞,并在之后的4.8年持续存在,患者体内已经检测不到具有复制能力的HIV病毒,该患者在在移植之后37个月停止了ART治疗,并且在之后的18个月中都没有出现病毒血症。

有2名HIV患者参与了国际母婴青少年艾滋病临床试验(IMPAACT)P1107临床研究(NCT02140944,这是一项观察性研究,受试者为大于12个月的因疾病(如血液恶性肿瘤)需要异体干细胞移植的HIV患者),第一名患者是一位感染HIV-1,患上了霍奇金淋巴瘤的中年男性,他接受了 CCR5 32/32 的脐带血混合单倍体干细胞移植。他在移植后一年内失去CCR5 32/32供体细胞,并死于霍奇金淋巴瘤复发。第二名患者是一名自我认定为混血的女性患者,她在诊断HIV时血浆中病毒载量已经超过了定量的最大极限1000000拷贝每毫升,已经接受了4年的ART治疗,并且一直控制得不错,但仍能检测到HIV病毒的存在。但是在她被诊断患有HIV的4年之后,又被诊断为急性髓系白血病(AML),并接受了标准化疗,在化疗期间,她出现过一次短暂的低水平的病毒血症,HIV病毒载量达到150拷贝/毫升。研究人员从StemCyte国际脐带血中心注册库中找到了5个匹配的CCR5 32/32脐带血单位,还找到了一个具有亲缘关系的单倍体相合的CCR5野生型成年人供体。在2017年,她进行了一次单倍体相合干细胞结合脐带血细胞移植,首先从单倍体相合的成年人供体的外周血中选择CD34细胞移植,之后进行CCR5 32/32脐带血细胞移植。移植后2周,她82%的淋巴细胞和98%的髓系细胞都来自于单倍体相合的供体;14周后,淋巴和髓系细胞都100%被CCR5 32/32来源的细胞替代,6个月后,B细胞恢复到正常水平;13个月后,CD4 和CD8 T细胞和自然杀伤细胞恢复并维持正常水平。并且在移植后超过55个月的后续观察时,她体内已经几乎检测不到HIV的RNA了。CCR5 32/32 haplo-cord移植治愈第一例女性HIV患者总的来说,这项研究报道了第一例女性HIV可能治愈病例,该患者接受了CCR5 32/32的脐带血移植,结合单倍体相合的干细胞移植,治愈了AML和HIV。但是细胞移植仍然具有极大的局限性,即很难找到适配且是CCR5 32/32纯合突变的供体,希望未来的研究可以为更多的HIV患者带来治愈的曙光。
https://doi.org/10.1016/j.cell.2023.02.030
1. Liu, R., et al., Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection. Cell, 1996. 86(3): p. 367-77.2. Samson, M., et al., Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature, 1996. 382(6593): p. 722-5.3. Dean, M., et al., Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Hemophilia Growth and Development Study, Multicenter AIDS Cohort Study, Multicenter Hemophilia Cohort Study, San Francisco City Cohort, ALIVE Study. Science, 1996. 273(5283): p. 1856-62.4. Paxton, W.A., et al., Relative resistance to HIV-1 infection of CD4 lymphocytes from persons who remain uninfected despite multiple high-risk sexual exposure. Nat Med, 1996. 2(4): p. 412-7.5. Huang, Y., et al., The role of a mutant CCR5 allele in HIV-1 transmission and disease progression. Nat Med, 1996. 2(11): p. 1240-3.6. Michael, N.L., et al., The role of viral phenotype and CCR-5 gene defects in HIV-1 transmission and disease progression. Nat Med, 1997. 3(3): p. 338-40.7. Martinson, J.J., et al., Global distribution of the CCR5 gene 32-basepair deletion. Nat Genet, 1997. 16(1): p. 100-3.8. Hütter, G., et al., Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation. N Engl J Med, 2009. 360(7): p. 692-8.9. Gupta, R.K., et al., HIV-1 remission following CCR5Δ32/Δ32 haematopoietic stem-cell transplantation. Nature, 2019. 568(7751): p. 244-248.10. Gupta, R.K., et al., Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report. Lancet HIV, 2020. 7(5): p. e340-e347.11. Reardon, S., Third patient free of HIV after receiving virus-resistant cells. Nature, 2023. 615(7950): p. 13-14.12. Jensen, B.O., et al., In-depth virological and immunological characterization of HIV-1 cure after CCR5Δ32/Δ32 allogeneic hematopoietic stem cell transplantation. Nat Med, 2023.