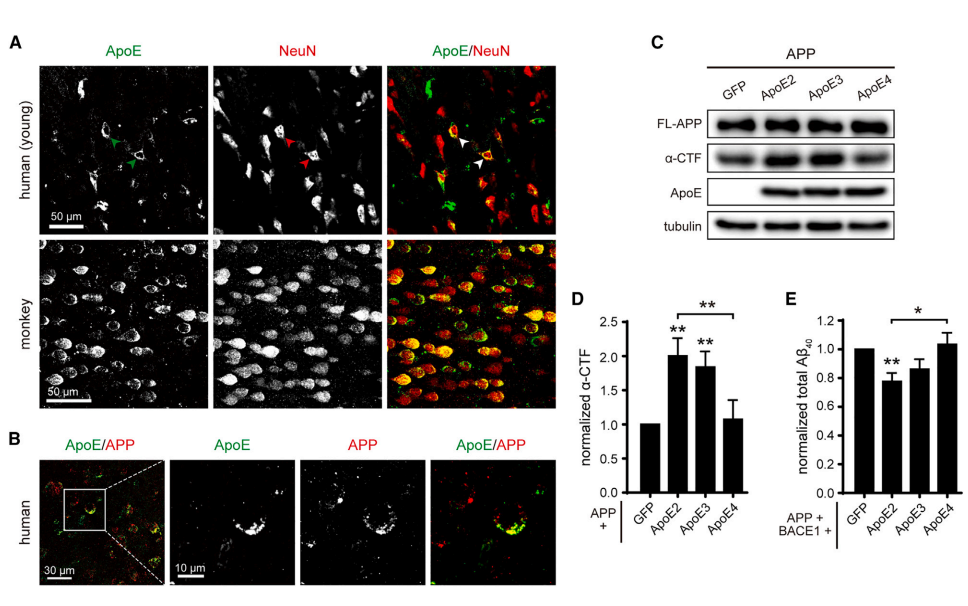
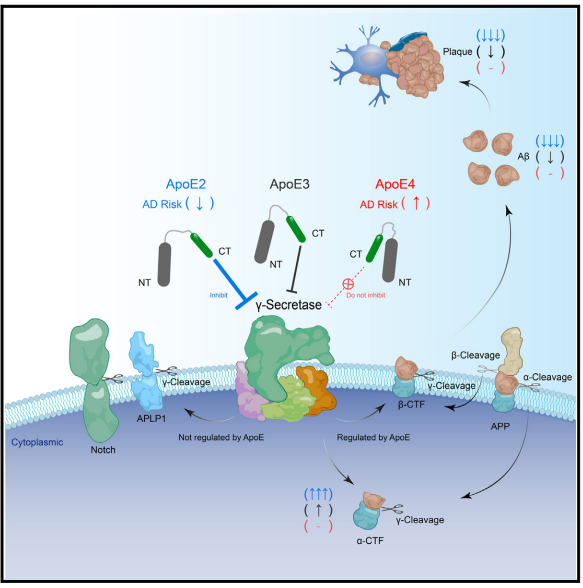
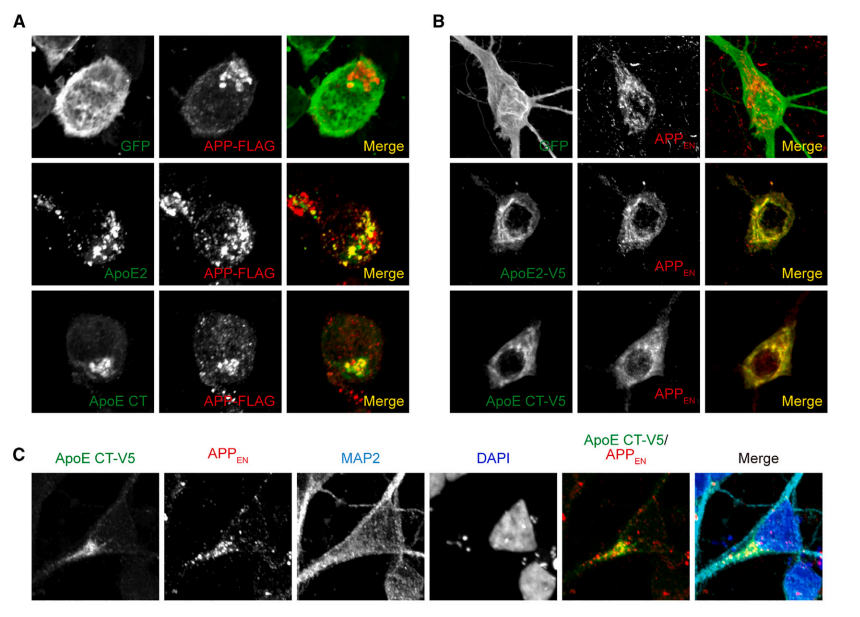
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性疾病,可影响大脑认知、记忆能力。根据国际阿尔茨海默症协会的数据,全球有5000多万痴呆症患者,AD是痴呆症最常见的形式,其中绝大多数患者为非家族遗传性AD。为此,我们亟需可以有效治疗AD的可用方法。近日,中国科学院生物与化学交叉研究中心(上海有机化学研究所)陈椰林团队在《神经元》(Neuron)发表论文,揭示了阿尔茨海默病全新的病理机制。研究团队发现了非家族遗传性AD的致病风险因子ApoE4与家族遗传性AD致病机理的关系,从而为AD的潜在疗法指明了方向。AD患者大脑中的病理特征之一是存在大量淀粉样蛋白(Aβ)斑块,但是目前淀粉样蛋白斑块与认知、记忆能力下降的关系仍然存在争议。当下AD致病机制的认知多来源于对家族遗传性AD(fAD)的研究,这也是淀粉样蛋白假说的依据,即Aβ的过度聚集会加速AD的发生。理论上淀粉样前体蛋白(APP)会在特殊酶的作用下连续裂解产生多肽,而在关键的γ分泌酶的酶切活性中心(PS1和PS2),一些突变会加速淀粉样斑块的形成,最终导致fAD。尽管对fAD的研究颇多,但其仅占所有AD病例的约1%,另外约99%是非家族遗传性的散发性AD(sAD),而sAD患者并不携带导致fAD的APP或者PS1/2突变。实际上,载脂蛋白E4(ApoE4)是sAD最大的风险因子。人群中,约有14%的人携带至少一个ApoE4基因。与携带正常ApoE3的人相比,携带2个ApoE4拷贝的人患AD的风险增加10倍,并且患病年龄会提前至70岁之前,疾病进程也大大加速。而另外一个变体ApoE2却能显著降低AD的发病风险。▲ApoE2会减少淀粉样蛋白的产生(图片来源:参考资料[1])令人惊讶的是,虽然对AD的影响截然不同,ApoE2、ApoE3和ApoE4蛋白的氨基酸序列却非常相似,仅有1-2个位点不同。目前,科学界并不清楚为什么同一基因编码的不同ApoE异构体在AD进程中发挥着截然相反的影响。此外,sAD风险基因ApoE与fAD致病基因APP和γ分泌酶之间是否有功能上的联系也仍是模糊的。▲研究揭示了非家族遗传性AD的致病风险因子ApoE4相关的致病机理(图片来源:参考资料[1])在新研究中,陈椰林团队发现ApoE异构体带来的致病风险与其直接特异性抑制APP的γ剪切活性相关,提出了ApoE异构体改变AD风险的新理论。论文指出,正是因为ApoE2具有最强的抑制活性,而ApoE4则失去了该活性,这才导致了两者拥有了完全不同的致病后果。该理论首次将fAD和sAD的风险基因从功能上直接联系在一起,提示APP的γ酶切异常是fAD和sAD共同的致病原因。▲ApoE与APP、γ分泌酶互相作用(图片来源:参考资料[1])目前,临床上已经验证了一些基于清除Aβ的sAD治疗方法,但是该类型疗法的治疗效果有限,仅能部分减缓AD的恶化。研究推测这有可能是因为,目前的抗体治疗仅仅能清除已经从细胞中分泌出来的Aβ及其在细胞外聚集而成的淀粉样蛋白斑块。实际上有证据表明细胞内的Aβ也具有毒性,抗体治疗还无法触达这些Aβ。另外,新研究还发现ApoE活性区域可以精准定位神经元以及淀粉样斑块周边的Aβ高发区域,以高特异性的方式从源头抑制脑细胞内Aβ的生成,达到减少淀粉样斑块的目的。因此,上述发现可能为潜在的AD疗法带来全新方向。中国科学院生物与化学交叉研究中心(上海有机化学研究所)陈椰林课题组的侯祥龙博士和博士生张雪馨为该论文的第一作者,陈椰林研究员和耿泱副研究员为该论文的通讯作者。该工作得到了交叉中心张在荣研究员和王文元研究员的协助和支持。该项研究受到了中国科学院和上海市科技重大专项基金的资助支持。
参考资料:
[1]Differential and substrate-specific inhibition of g-secretase by the C-terminal region of ApoE2, ApoE3, and ApoE4. Neuron (2023). DOI: https://doi.org/10.1016/j.neuron.2023.03.024