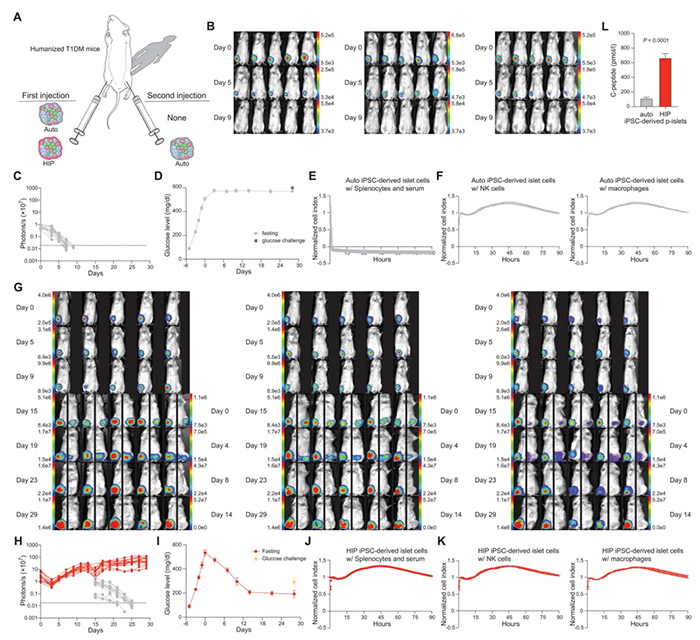
胰岛素已被用于治疗1型糖尿病(T1DM)超过100年之久,从而将这种曾经的致命疾病转变为一种医学可控的慢性疾病。然而,1型糖尿病的发病率、死亡率和生活质量仍然是一个问题,尤其是对于其中25%的低血糖感知受损(IAH)患者,他们处于严重低血糖事件和相关发病率的高风险中。然而,当前的治疗药物以及血糖监测设备,既不能治愈1型糖尿病,也不能消除血糖水平不确定性及其带来的负担。异基因胰岛移植能够补充缺失的胰岛β细胞群,对有严重低血糖事件史的IAH患者的临床试验表明,它可以控制血糖,恢复低血糖感知,并保护1型糖尿病患者免受严重低血糖事件影响。之前的临床试验随访数据显示,在免疫抑制下,异基因胰岛移植的功能平均持续时间为4.4至5.9年。然而,异基因胰岛抑制后,即刻经血液介导的炎性反应会导致抑制的胰岛丧失,还需要终生使用免疫抑制药物,而免疫抑制会导致多种副作用,包括β细胞毒性、肾毒性、感染和癌症等,这大大限制了该策略在1型糖尿病中的广泛使用。2023年4月12日,Sana Biotechnology 的研究人员在 Science Translational Medicine 期刊发表了题为:Human hypoimmune primary pancreatic islets avoid rejection and autoimmunity and alleviate diabetes in allogeneic humanized mice 的研究论文。在这项研究中,Sana Biotechnology 的研究团队报告了不需要免疫抑制的人类异基因、基因工程低免疫胰岛移植的概念验证,在临床前模型中,异基因低免疫胰岛可以避免异基因和自身免疫反应,并提供血糖控制。异基因胰岛移植已成功应用于难以控制的胰岛素依赖型糖尿病和低血糖感知受损(IAH)的糖尿病患者。但这种治疗方法需要终身使用免疫抑制药物,这严重阻碍了这种细胞替代疗法在更广大糖尿病患者群体中的广泛使用。在这项研究中,Sana Biotechnology 的研究团队利用CRISPR-Cas9基因编辑技术敲除了人原代胰岛细胞中编码I类和II类MHC的基因,并过表达了CD47,防止其被先天免疫细胞杀伤,然后将这些低免疫(HIP)细胞重新聚集为假胰岛(p-islets),并将其移植到糖尿病人源化小鼠体内。结果显示,人类低免疫假胰岛在免疫功能正常、异基因的糖尿病人源化小鼠模型中被能够存活、定植并改善糖尿病,并避免被自身免疫系统杀伤。未编辑或部分编辑的低免疫假胰岛细胞的存在不会损害成功编辑的低免疫假胰岛细胞的存活和内分泌功能。研究团队还考虑到CD47过表达可能带来的潜在失控问题,他们使用CD47靶向融合蛋白,抑制CD47的过表达,作为安全开关,能够快速可靠地消除体内的低免疫假胰岛细胞。这位未来在临床中使用这种疗法提供了安全策略。由于不需要免疫抑制,该方法更够促进胰岛移植在糖尿病中的应用,帮助更多有IAH和严重低血糖事件史的糖尿病患者摆脱胰岛素注射。值得一提的是,2023年4月10日,Sana Biotechnology 的研究人员在 Nature 子刊 Nature Communications 期刊发表了题为:Hypoimmune anti-CD19 chimeric antigen receptor T cells provide lasting tumor control in fully immunocompetent allogeneic humanized mice 的研究论文。该研究通过CRISPR-Cas9基因编辑敲除了T细胞的TRAC、B2M和CIITA基因,从而构建出了人类低免疫(HIP)T细胞。然后,使用慢病毒载体让这些HIP T细胞过表达CD47和CD19 CAR,构建出了异基因HIP CD19 CAR-T细胞。该研究进一步证明了,异基因HIP CD19 CAR-T细胞在免疫功能正常的人源化小鼠肿瘤模型中是安全的,且能够实现持久、有效的肿瘤清除效果。该研究表明,基于低免疫T细胞的“通用型”CAR-T细胞疗法能够达到目前只有自体CAR-T细胞疗法才能达到的治疗效果,这有助于更广大的癌症患者及时获得细胞治疗。1. https://www.science.org/doi/10.1126/scitranslmed.adg5792. https://www.nature.com/articles/s41467-023-37785-2