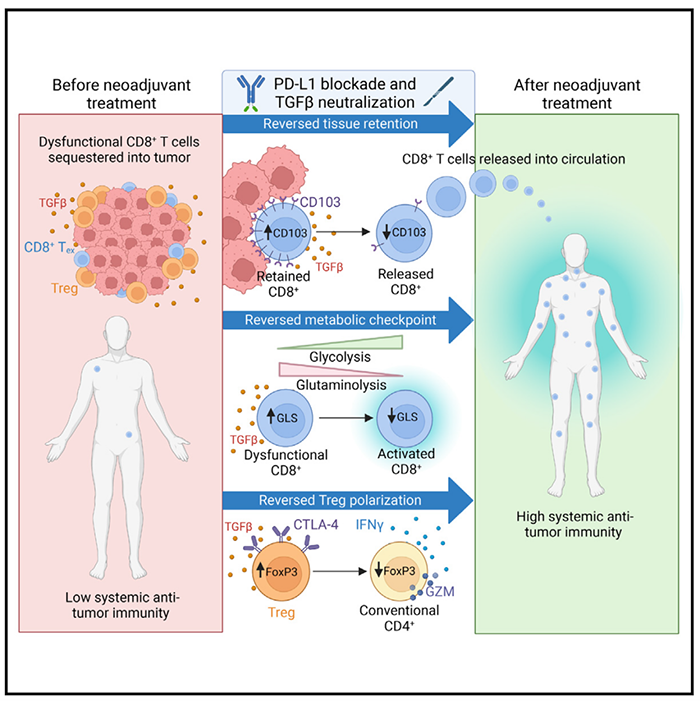
肿瘤免疫疗法是当今癌症治疗的热门方向,但是免疫抑制性的肿瘤微环境使得该方法仍具有许多局限。T细胞表面表达的抑制性受体PD-1是一个免疫检查点,可以抑制下游T细胞受体信号传递并限制T细胞激活;肿瘤微环境中的抗炎性细胞因子TGF-β可以促进调控性CD4+ T细胞(Treg)极化,直接抑制效应T细胞的功能。基于T细胞的新辅助免疫疗法(NIT)是针对这种免疫抑制机制而开发的疗法,可以显著改善一些实体瘤的临床结果,但是不同的T细胞亚型如何响应NIT仍然不清楚。近日,来自美国国立卫生研究院的Clint T. Allen研究团队在Cancer Cell上发表题为Phenotypic plasticity and reduced tissue retention of exhausted tumor-infiltrating T cells following neoadjuvant immunotherapy in head and neck cancer 的文章,发现耗竭性肿瘤浸润CD8+ T细胞(Tex)对同时抑制TGF-β和PD-L1的新辅助免疫疗法(NIT)具有局部和系统性反应,NIT可以激活耗竭性肿瘤渗透性CD8+ T细胞,提高其T细胞受体活性并改变其代谢,还可以使得CD4+调控性T细胞朝向效应型转变,逆转肿瘤特异性T细胞的组织驻留可能可以强化系统性抗肿瘤免疫。为了研究新辅助疗法的分子和细胞机制,研究人员从一项临床研究(NCT04247282)中的6名新诊断的,与人类乳头状瘤病毒(HPV)无关的头颈部鳞状细胞癌(HNSCC)晚期,经过2次bintrafusp alfa(一种可以抑制PD-L1和TGF-β的双功能性蛋白)新辅助疗法,未经过其他治疗的癌症患者取得组织活检样本。6名患者在经过新辅助疗法后都表现出不同程度(23%-46%)的肿瘤消退,根据目前的病理反应标准,病理反应<50%被认为是无反应。他们从治疗前后的组织活检肿瘤样本中分离了肿瘤浸润淋巴细胞(TIL),然后进行了单细胞RNA测序和T细胞受体(TCR)测序,分析结果显示CD4+和CD8+ T细胞类群内具有较大的转录组差异和表型异质性。为了检测肿瘤浸润T细胞的抗原特异性,他们将焦点集中在了患者治疗前后的样本中都出现的克隆型,其中一名患者样本中共同出现的克隆型和对应细胞数目最多,于是他们选择了该患者的20个共同的克隆型的TCR,将其克隆到该患者的外周血T细胞中,检测对于I型HLA限制性新抗原的活性,鉴定到了3个对肿瘤特异新抗原有活性的TCR,肿瘤特异性T细胞克隆型的非耗竭T细胞组分较低,耗竭和增殖组分较高,新辅助免疫疗法会导致肿瘤浸润性耗竭T(Tex)细胞的选择性富集。接下来他们检测了治疗前后TIL和血液循环中T细胞动态,发现NIT会导致血液循环中肿瘤浸润性耗竭T细胞克隆型选择性增加,并且血液循环中Tex克隆型的增加与组织驻留标记物CD103的表达降低相关,TGF-β可能是CD103表达和T细胞组织驻留的驱动因素,逆转肿瘤特异性T细胞的组织驻留状态可能可以促进系统性抗肿瘤免疫。然后他们对CD8+ T细胞进行分析,发现NIT会导致TCR信号通路和谷氨酰胺代谢发生变化,因此NIT会激活肿瘤浸润耗竭CD8+ T细胞,这些T细胞的TCR活性增加,代谢发生变化。不同的CD4+ T细胞亚型对抗肿瘤免疫的影响不同,细胞毒性和Th1 CD4+ T细胞可以促进抗肿瘤免疫,而Treg却具有免疫抑制性。他们发现NIT会使得Treg出现表型不稳定性,NIT导致的TGF-β中和可能会使得Treg朝向Tex表型转变。总的来说,这项研究揭示了NIT之后肿瘤和外周血中的T细胞动态变化,NIT激活耗竭性肿瘤特异性CD8+ T细胞,促进组织驻留的CD8+ T细胞进入循环系统,改变其TCR活性和代谢活性,并使得调控性CD4+ T细胞朝向效应表型转化,未来抑制T细胞组织驻留可能是一个值得探索的新辅助疗法策略。https://doi.org/10.1016/j.ccell.2023.03.014