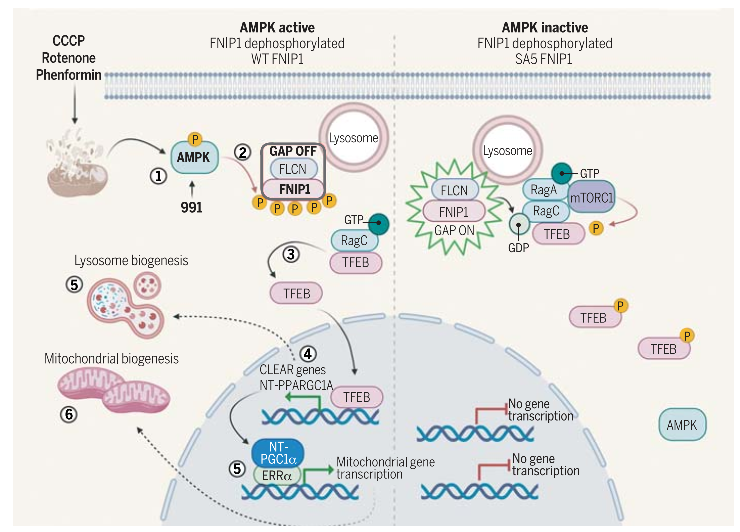
在营养缺乏或者线粒体功能异常的情况下ATP水平迅速下降,真核生物中AMPK信号通路会被迅速激活。AMPK会促进代谢适应,增加促进溶酶体和线粒体生物发生的基因表达。其中转录因子TFEB是AMPK依赖的信号效应因子,但是AMPK信号通路的很多调控细节仍然是未知的。为此,美国Salk研究所Reuben J. Shaw研究组在Science发文题为Induction of lysosomal and mitochondrial biogenesis by AMPK phosphorylation of FNIP1,发现先前鉴定的AMPK相互作用蛋白FNIP1(Folliculin-interacting protein 1)作为AMPK的底物控制TFEB转运到细胞核中,从而在代谢应激胁迫情况下增加溶酶体和线粒体生物合成。适应营养缺乏的能力是生物生存的基本特征。AMPK信号通路会在几分钟之内被营养缺乏迅速激活。如果营养缺乏的时间延长,代谢过程会被不同的基因表达调节程序调控。TFEB以及相关的转录因子TFE3为营养缺乏以及能量胁迫所激活,并且会被mTORC1信号通路以及AMPK信号通路所调节。mTORC1直接磷酸化TFEB从而导致TFEB被移出细胞核。氨基酸调节mTORC1磷酸化TFEB能力,这一过程主要是通过FLCN-FNIP1复合体。AMPK信号通路在能量胁迫中对TFEB转运入核是必须的,但是这一过程如何调节尚不清楚。最近有研究表明AMPK可以磷酸化TFEB,这些磷酸化位点溶酶体基因转录中发挥作用【1】。但是作者们发现这三个位点与AMPK底物识别序列并不匹配,突变这些位点也不会影响TFEB和TFE3被运转入核能力。因此,AMPK并不会直接磷酸化TFEB转录因子。为了揭开在能量胁迫中AMPK依赖的磷酸化事件,作者们对HEK293T细胞中AMPK进行了敲除,随后分别对野生型以及AMPK敲除型细胞进行电子传递链抑制剂处理。之后,作者们进行了长达16小时长时程RNA- seq,从中作者们发现TFEB是最为富集的转录因子。在AMPK底物筛选实验中,作者们发现了调节细胞生长和代谢的因子FNIP1【2】。FNIP1是FLCN相互作用伴侣,并且与AMPK相互作用。通过对FNIP1序列分析,作者们发现FNIP1蛋白序列具有与AMPK相匹配的底物序列。通过质谱分析,作者们对FNIP1在体内的磷酸化进行了检测,确认了FNIP1在体内尤其是能量胁迫情况下会被高度磷酸化。进一步地,通过底物磷酸化测试以及构建磷酸化抗体证实了FNIP1会被AMPK直接磷酸化。随后,作者们发现AMPK依赖的FNIP1磷酸化过程会控制mTORC1结合到TFEB和TFE3之上,而这一过程主要是通过抑制FNIP1-FLCN的GAP活性、驱动RagC非活性形式的累积实现的。为了对AMPK和FNIP1是如何影响溶酶体生物学特征进行探究,作者们对细胞中能量胁迫基因表达变化进行检测,发现溶酶体生物合成基因表达发生了显著变化。另外,作者们发通过转录因子分析发现AMPK对FNIP1的磷酸化也会诱导线粒体生物合成基因的表达变化。总的来说,作者们的工作揭开了一直以来AMPK将TFEB转入细胞核关键因子FNIP1,并且发现AMPK对于FNIP1的磷酸化会诱导溶酶体和线粒体的生物合成基因表达程序(图1),从而帮助细胞应对营养缺乏的环境。
原文链接:
https://doi.org/10.1126/science.abj5559
1. M. Paquette et al., AMPK-dependent phosphorylation is required for transcriptional activation of TFEB and TFE3. Autophagy 17, 3957–3975 (2021). doi: 10.1080/ 15548627.2021.1898748; pmid: 337340222. D. M. Gwinn et al., AMPK phosphorylation of raptor mediates a metabolic checkpoint. Mol. Cell 30, 214–226 (2008).doi: 10.1016/j.molcel.2008.03.003; pmid: 18439900