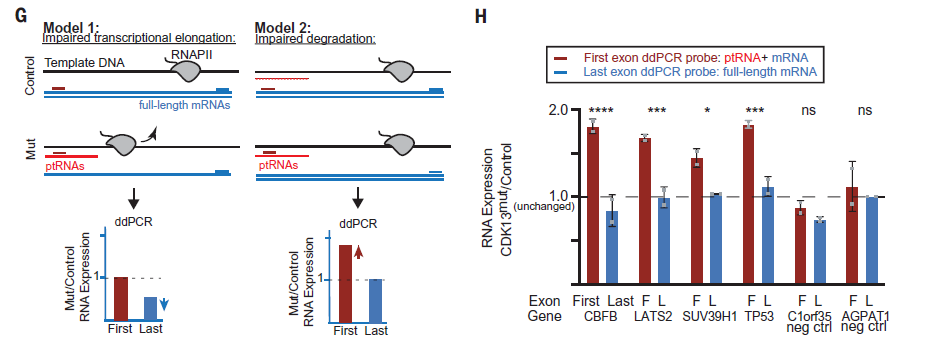
细胞周期蛋白依赖性激酶 (CDKs) 是一组可以直接调控基因表达的激酶家族,其中,CDK13正被作为许多难治性癌症的治疗靶标进行研究,但其在转录和RNA加工中的作用仍然知之甚少。在转录延伸过程中,RNA加工错误会导致异常的转录本产生,随之被RNA监视途径降解。简单来说,异常或不稳定的核RNAs被接头复合物识别,接头复合物将MTR4解旋酶和核RNA外切体复合物募集到特定RNA。最近报道的PAXT(polyA exosome targeting)复合物靶向ptRNA(prematurely terminated RNAs)进行降解【1, 2】,但人们对PAXT靶向ptRNA而非mRNA的机制仍不了解。近日,来自美国霍华德·休斯医学研究所的Leonard I. Zon团队在Science杂志上发表了一篇题为 Oncogenic CDK13 mutations impede nuclear RNA surveillance 的文章,他们发现黑色素瘤中CDK13的激酶结构域频发突变,这些突变会加速斑马鱼黑色素瘤模型的肿瘤发生。就机制而言,他们发现CDK13负责激活核RNA监视途径,当CDK13发生失活突变或缺失时,PAXT亚基ZC3H14的磷酸化受损,使ptRNA无法成为降解目标,积累的ptRNAs引发斑马鱼加速黑色素瘤发生。作为证据支持,他们还观察到CDK13磷酸化募集的PAXT亚基在17%的黑色素瘤中发生突变,其中,ZFC3H1和ZC3H18两种组分在多种癌症类型中反复突变。总之,这项工作表明CDK13通常会激活核RNA监视机制以降解致癌性ptRNAs。研究人员首先在TCGA数据库和另一个公开可用的黑色素瘤数据库中分别检索到CDK13在4.6%和3.9%的黑色素瘤患者中发生体细胞突变,且富集于其激酶结构域,在斑马鱼黑色素细胞及人A-375黑色素瘤细胞中过表达这些CDK13突变体能加快黑色素瘤的发生及细胞增殖。为了了解内在机制,研究人员通过量化差异外显子来检测整体的RNA表型(下图),具有CDK13mut的患者第一个外显子与最后一个外显子比值增加,表明存在ptRNAs且是聚腺苷酸化的。紧接着,作者用3’RNA-seq来确定ptRNAs在CDK13mut黑色素瘤中的终止位置,然而与对照相比,CDK13mut中鉴定出1678个终止事件,且缺乏共享的功能通路,提示在斑马鱼和人细胞系中观察到的增殖表型可能是由累积的截短RNAs产生的细胞应激促进的,而与特定靶基因的截短无关。关于ptRNA在细胞中积累的模型有两种假设,一种是转录延伸受损,那么ptRNA的产生将以牺牲全长mRNA为代价,另一种是ptRNA的清除受损,那么ptRNA的增加不影响全长mRNA表达。作者利用ddPCR来验证上述模型,来自第一个外显子探针的信号则代表ptRNA和全长mRNA,而来自最后一个外显子探针的信号仅代表全长mRNA,结果显示与对照相比,所有检测的基因在CDK13mut细胞中未显示最后一个外显子的表达改变,表明ptRNAs由于缺乏有效的清除而在CDK13mut细胞中积累,即模型2是正确的。需要注意,作者利用串联质谱实验观察到蛋白N端肽水平增加,提示ptRNAs没有被外切体复合物降解,而是被翻译表达成截短蛋白,且包含部分内含子序列,这可能导致肿瘤特异性新抗原的产生。图1. CDK13突变会导致ptRNAs在细胞中积累。为了阐明CDK13mut如何通过转录后机制导致ptRNAs积累,作者用MS鉴定与过表达的CDK13WT免疫共沉淀 (IPed)的蛋白,其中,ZC3H14作为负责ptRNA降解的PAXT复合物的亚基。基于此,作者假设CDK13激酶活性的丧失将无法激活PAXT,从而导致黑色素瘤中积累ptRNAs。为了证明这点,作者在有无CDK14激酶活性的条件下表征ZC3H14的磷酸化及其结合对象。在CDK13mut细胞中,ZC3H14在S475处失去磷酸化,且会减弱与THOC2、ZFC3H1 和 MTR4的结合,它们都与ptRNAs的降解相关。作者用siRNA处理细胞并过表达ZC3H14的不可磷酸化和拟磷酸化突变体(ZC3H14S475A/E),证明S475位点的磷酸化对于激活PAXT对ptRNAs的降解是必要的,且影响黑色素瘤细胞的生长速率。最后,他们对包含多种肿瘤类型的患者肿瘤样本的公开RNA-seq数据进行分析确认ptRNAs在其他CDK13mut癌症中也会积累,在斑马鱼模型中表达两种人类ptRNAs均能加速黑色素瘤的发生。此外,作者还观察到PAXT衔接蛋白ZFC3H1在多种癌症中反复发生突变。总的来说,这项工作表明CDK13具有与肿瘤抑制因子一致的特性,CDK13突变体由于引发RNA监视系统故障而致癌,且PAXT组分在多种癌症中发生反复突变,这些数据表明核RNA监视系统具有广泛的、以前未被认识到的肿瘤抑制作用。
原文链接:
https://doi.org/10.1126/science.abn7625
1. N. Meola et al., Identification of a nuclear exosome decay pathway for processed transcripts. Mol. Cell 64, 520–533 (2016). doi: 10.1016/j.molcel.2016.09.025; pmid: 278714842. K. Ogami et al., An Mtr4/ZFC3H1 complex facilitates turnover of unstable nuclear RNAs to prevent their cytoplasmic transport and global translational repression. Genes Dev. 31, 1257–1271 (2017). doi: 10.1101/gad.302604.117; pmid: 28733371