背景
DNA修饰在原核细胞限制性修饰 (RM)机制中的作用早在 50多年前就已被证实。然而,对非RM相关修饰的流行和相关功能的多样性仍没有被完全理解。阅读时间长、修饰敏感的SMRT测序技术促进了多种基因组的测序和组装,也澄清了修饰库。对于m6A、m4C和氧化形式的m5C修饰碱基 (m5hC和5caC),可以检测碱基的修饰状态。最近,对230种不同细菌和古细菌甲基体的高通量分析惊人地揭示,几乎50%的生物体携带II型DNA甲基转移酶 (MTase)同源物,但没有明显的同源限制性内切酶 (RE)。这些 “孤立”MTase有时表现出不完全甲基化模式,这使其区别于RM系统MTase,后者能够在不同细菌和古细菌门的基因表达和DNA复制调节中发挥作用。对这两种MTases的遗传和生化研究使我们提出,它们在体内与DNA聚合酶I协同修饰单链DNA。
简介
2020年12月3日,来自美国马萨诸塞州的新英格兰生物抗体有限公司的Elisabeth A. Raleigh和Richard J. Roberts在Nucleic Acids Res (IF: 11.501)上发表了Plasmid replication-associated single-strand-specific methyltransferases一文[1]。本研究旨在简要介绍了用于本研究的复制子以及揭示ssDNA底物的体内机制。
主要结果
体内m6A修饰仅作用于复制中的前导链
在lacp或tetp控制下,将异常质粒携带的MTases M . EcoGIX和M . BceJIII克隆到组成型表达载体pRRS中,然后在甲基化缺陷型宿主大肠杆菌2796中繁殖。这些质粒DNA的SMRT测序显示,在基序SAY (其中S=C或G;Y=C或T)处有退化m6A修饰,但几乎仅在一条链上 (图1)。奇怪的是,在DNA制备过程中携带的基因组DNA上未检测到m6A修饰。为了探索这种不寻常的链特异性质粒甲基化的特性,我们在pAF3中反转了ColE1复制起点,产生了pEYY63。令人惊讶的是,m6A修饰模式改变了链,表明体内的MTase活性与质粒复制过程相关,特异性修饰了前导链 (图1)。同样,基因组DNA不含m6A。
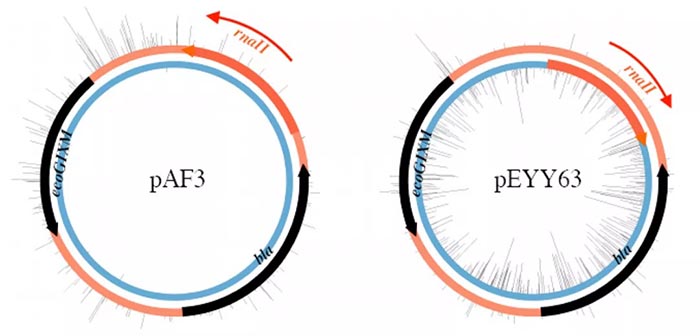 图1. ColE1 ori方向决定哪条链被M.EcoGIX修饰。黑色刻度: 观察到的m6A修饰位点。黑色箭头: β-内酰胺酶 (bla)和MTase (ecoGIXM)的编码序列。粗橙色箭头: 复制起点(ori),由RNAII的核苷酸序列确定。RNAII启动了DNA合成的前导链,方向为细橙色箭头。
图1. ColE1 ori方向决定哪条链被M.EcoGIX修饰。黑色刻度: 观察到的m6A修饰位点。黑色箭头: β-内酰胺酶 (bla)和MTase (ecoGIXM)的编码序列。粗橙色箭头: 复制起点(ori),由RNAII的核苷酸序列确定。RNAII启动了DNA合成的前导链,方向为细橙色箭头。
His标记的大肠杆菌和大肠杆菌的体外特性
具有复杂底物的单链优先。
来自体外表达 (‘PUR Express’mtase)的标记WT蛋白显示出荧光造影可见的活性 (图2),其底物为单链而非双链 (M13mp18病毒体或RFI;图2B)。当从Ni-NTA珠上的粗提取物中纯化相同的6xHis标记的WT M . BceJIII和M.EcoGIX时,单链M13mp18 DNA底物被修饰 (图2D)。利用Ni-NTA洗脱馏分和双链M13mp18,在小片段中发现了一些活性 (图2D)。来源于粗提取物的大肠酶仍然存在于这些组分中,我们推测H3标记的DNA模式可能代表了由外来活性产生的单链间隙处的作用。反之,这可能表示由于酶浓度高而产生的脱靶 (“星形”)活性。体外表达的His标记MTases中未发现RNA修饰活性;这些样品在M13单链DNA上具有活性。
与天然蛋白一样,从粗提取物中进一步纯化活性His标记的MTase蛋白的所有尝试都失败了。Ni-NTA咪唑洗脱馏分和HiTrap QHP馏分保持活性。使用肝素柱的任何额外纯化步骤均导致M.EcoGIX和M . BCE gii的MTase活性损失超过 90%。我们确实获得了高纯度但无活性的MTase多肽。
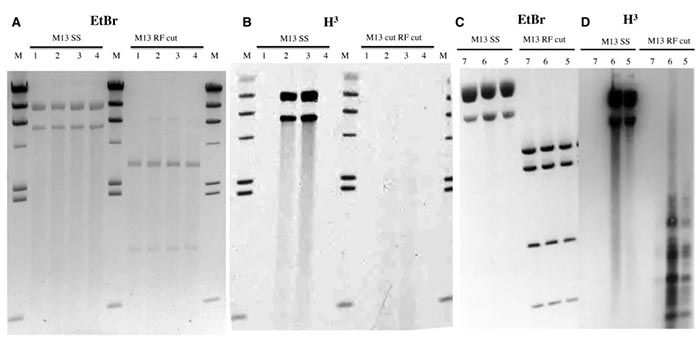
图2. MTase活性需要单链。面板(A)和(C):用溴化乙锭染色的M13基底。面板(B)和(D):使用[H3]SAM修饰反应的荧光图。M13 SS:病毒粒子DNA底物。在标记反应之后消化M13 RF切割:DS复制中间体RFI,用于视觉简化;NdeI (A和B)或NdeI+Bam Hi (C和D小组)。所述底物用用PURExpressin体外转录-翻译获得的MTase蛋白处理 (图A和B)或用体内合成的部分纯化 (Ni-NTA纯化)蛋白处理 (图C和D)。泳道1)空的pSAPv6向量,2) M.BceJIII WT (pAF9),3) M.EcoGIX WT (pAF10)和4) M.EcoGIX APPA变体 (pAF11)。H3放射性标记的标记(M)是由M.EcoGII在A .修饰的HindIII消化的lambda DNA。
DNA聚合酶I (PolI)可能是活性结核分枝杆菌的一种成分
活性复合物的免疫印迹和交互免疫沉淀特性
为了通过独立方法研究PolI效应,我们使用蛋白质印迹法检测了6xHis::M.BceJIII的活性和非活性部分,以通过抗6×His-Tag小鼠抗体(图3,A组,上凝胶)和抗DNA聚合酶I兔抗体 (图3,A图,下凝胶)进行检测。在两种组分中均检测到MTase,而仅在活性组分中检测到PolI。测试相同组分的修饰性和聚合酶活性。仅在具有活性MTase活性组中检测到DNA聚合 (dTTP掺入) (图3,B图)。
为了确认相同复合物中是否存在DNA聚合酶I和MTase,我们使用空载体或野生型或催化缺陷型M.EcoGIX和M . BceJIII等位基因对ER3081粗提物进行了重复免疫沉淀(IP)分析(图3,C图)。6×His表位标记的MTase多肽的IP使用抗His单克隆抗体,使用抗PolI多克隆兔抗体进行蛋白质印迹显象,而PolI的IP采用抗PolI兔抗体,使用抗His单克隆抗体进行蛋白质印迹显象。
His标记的MTase蛋白沉淀可回收PolI (图3,C图,上图),而PolI沉淀可回收His标记的MTase蛋白 (图3,C图,下图)。根据在该泳道中回收的更强的PolI条带判断,M.EcoGIX突变变体可能与PolI有更强的相互作用,或形成比野生型MTases更稳定的复合物。
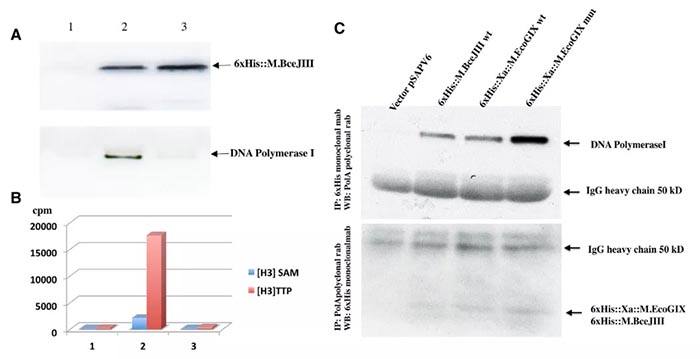
图3. 体内表达的活性MTase组分中Poll的免疫学和酶检测
结论与展望
DNA甲基转移酶的作用以及更普遍的表观遗传学在原核生物的生物化学和生理学中的作用正在积极拓展研究领域,部分原因是候选研究对象的激增。长期以来,MTases在RM过程中扮演着基因组保护者的角色。然而,SMRT测序的最新进展发现了许多与限制配偶体无明显联系的MTases。近乎50%被分析的原核生物中携带“孤立”II型MTases,且无明显的同源RE。
EcoGIX和M. BceJIII代表了这些孤立型MTases的一个家族,并在本研究中进行了描述。与许多孤立型家族不同,它们在原始生物体的实验室生长过程中保持沉默。在IncI1和IncF家族的接合质粒中发现了大量M.EcoGIX同源物。由于对其携带的致病性志贺毒素感兴趣,已对指定M.EcoGIX的IncI1质粒pESBL进行了广泛研究和鉴定。相关蛋白广泛分布于细菌中BLAST搜索在GenBank中鉴定出超过1000种大肠杆菌的潜在同源物,其中绝大多数与质粒相关。因此,了解MTases在这些质粒的传播和扩散中的作用具有普遍意义。
早期的研究显示ecoGIXM基因在其天然环境中转录,但无论质粒或宿主均没有在SAY位点被修饰。基因敲除该质粒中的MTase基因,显著降低了从突变供体到表达限制性内切酶受体的质粒成功活化水平: 具有非特征性R-M系统的EcoGIII或肺炎克雷伯菌分离株。因此,SMRT测序检测到缺乏供体修饰令人费解。在此,我们将分子遗传学方法与生物化学相结合,以实现酶的部分表征并概述其在细胞中的作用。主要得出以下结论:
当修饰由依赖polA的质粒携带时,其修饰靶向于前导链。
在我们人工表达的构建体中,MTase基因的组成型转录和翻译使它们的作用与缀合作用脱钩。质粒在这些便利载体中的复制是单向的,由ColE1的RNAII引物或其在p15A中的对应物上的Poll作用启动。我们提出,从质粒上其他地方 (或从另一个质粒)表达的MTase与Poll相关,通过RSII测序方案可读的修饰标记前导链 (图1)。与这种复制相关的R-环的持久性可以通过提供长寿命的单链底物来帮助。
在存在活性MTase的情况下,Poll依赖性质粒被排除在基因组竞争之外。单链噬菌体M13在体内被修饰但生长受限。在体外,单链DNA是底物。修饰活性与DNA多聚酶I相关。蛋白质与DNA聚合酶I融合既能修饰又能聚合。
在保护质粒不受进入新宿主的限制方面,M.EcoGIX的作用。
此处证明的Poll依赖性和单链MTase特异性使两个观察结果得以调和:M.EcoGIX在配对期间保护配偶体转移,但在供体中未发现修饰。偶联修饰的实现有两种途径:M.EcoGIX MTase可能与供体中的偶联装配相关联,因此转移链在转移过程中被甲基化。或者,M.EcoGIX可以修饰受体中的输入单链。后者需要单链MTase表达,如已知的其他偶联质粒的抗防御蛋白。
原文链接
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkaa1163/6018438
参考文献
1.Fomenkov Alexey,Sun Zhiyi,Murray Iain A et al. Plasmid replication-associated single-strand-specific methyltransferases.[J] .Nucleic Acids Res, 2020, undefined: undefined.













