近日,来自美国哈佛大学医学院附属麻省总医院的Kamila Naxerova团队在Cell杂志上发表了一篇题为 Increased stem cell proliferation in atherosclerosis accelerates clonal hematopoiesis 的文章,这项研究通过建立一个数学模型,确定了动脉粥样硬化诱导的造血干细胞增殖可以驱动克隆性造血作用。

为了确定动脉粥样硬化特征复合物是否会导致HSCs增殖,作者研究了动脉粥样硬化小鼠模型的造血功能。首先,作者给Apoe-/-小鼠喂食致动脉粥样硬化饮食,十周后相对于正常饮食小鼠而言,LSK HSPC(hematopoietic stem and progenitor cells)数量增加约2.1倍,同时外周血白细胞、中性粒细胞和单核细胞增加。进一步,作者收集了健康对照人群和无缺血性事件史的动脉粥样硬化患者的骨髓,与上述小鼠模型结果一致,动脉粥样硬化患者中Ki67阳性HSC的百分比增加约2.44倍,需要注意的是,队列中所有动脉粥样硬化患者的胆固醇水平得到充分控制,提示急性高脂血症并不是增殖率升高的原因。因此,这些结果表明动脉粥样硬化中存在造血系统增殖活性的慢性升高。
接下来,为了定量了解慢性升高的HSC增殖对CH出现的影响,作者基于群体遗传学的Moran过程建立了HSC动力学的随机模型,其中,两个最重要的参数即为HSC增殖率(模型中设为b)和驱动适应性优势(模型中设为s,固定值与特定的遗传变异相关)。为了获取这些参数的估计值,作者分析了多个数据集并校准模型,最终能够对不同HSC增殖条件下的驱动突变扩展速率作出了可验证的预测。
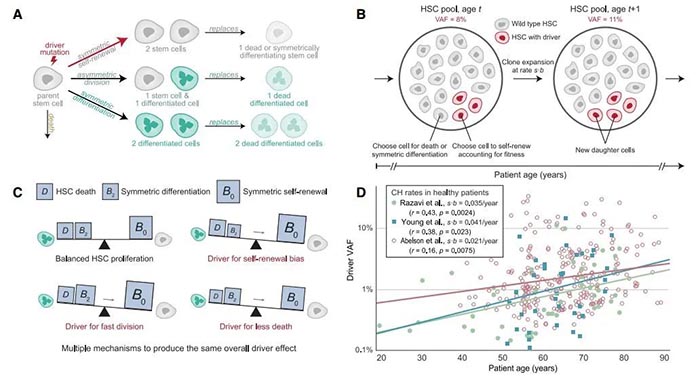
图1. HSC动力学的随机模型示意图
为了在实验上验证这个模型,作者研究了Tet2-/-细胞(Tet2-/-是克隆性造血的一种驱动突变)在Ldlr-/-小鼠模型(与上述Apoe-/-小鼠类似,同为动脉粥样硬化小鼠模型)中的演变。首先,将由细胞表面标记物CD45.2标记的Tet2-/-小鼠的骨髓与来自表达CD45.1的小鼠的野生型骨髓混合,并将混合物移植到致死剂量辐射的Ldlr-/-小鼠中。移植后四周,收集血样后将小鼠随机分为正常饮食组和动脉粥样硬化饮食组,在135天的时间内,每两周对这些小鼠外周血中的CD45.1和CD45.2组分进行评估,数学模型预测和流式细胞分析基本可以得出一致的结果:在喂食致动脉粥样硬化饮食的小鼠中,Tet2-/-组分显著更快地增加。
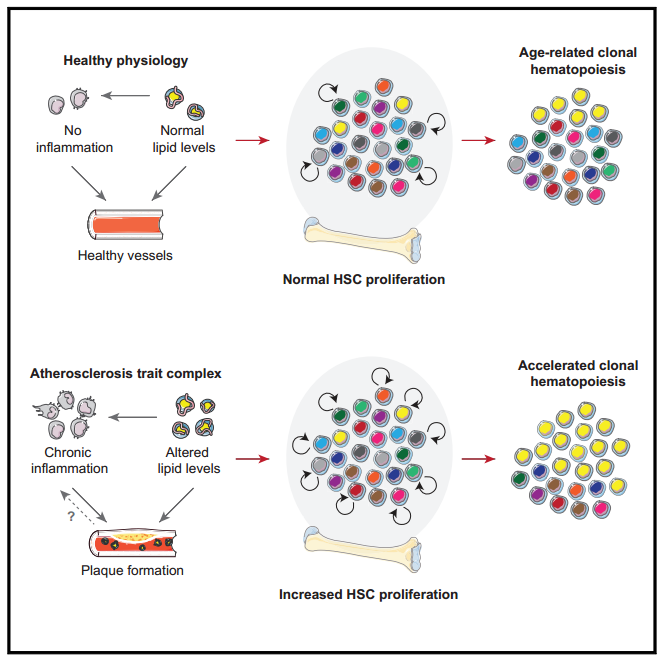
总的来说,在此前,一个悬而未决的问题是为什么不同CH相关基因的驱动突变在相同的程度上加剧动脉粥样硬化或者说冠心病罹患风险?本研究建立的数学模型提供了一个简单的解释,即风险的大小不是由驱动基因克隆中存在的特定突变决定的,而主要取决于健康人群和动脉粥样硬化人群之间HSC增殖率的平均差异。在尚未理清楚克隆性造血作用和动脉粥样硬化因果关系的当下,这项研究结果表明患者可能经历了动脉粥样硬化和克隆性造血之间的恶性循环,前者导致后者的出现,反过来,后者会推动前者的进一步发展。
原文链接:
https://doi.org/10.1016/j.cell.2021.01.049













