2021年3月瑞士苏黎世大学实验免疫学研究所病毒免疫生物学教授 Christian Münz于Nature communications发表文章Oxidation inhibits autophagy protein deconjugation from phagosomes to sustain MHC class II restricted antigen presentation其研究发现NADPH氧化酶2 (NOX2)产生的活性氧(ROS)通过抑制LC3从LAPosome胞质表面解偶联来稳定LaPosome,ATG4B的氧化还原调节是维持LaPoSomes LC3修饰的重要机制,以支持MHCⅱ类抗原呈递的抗原处理。
巨自噬(以下称自噬)有助于细胞内在的,先天和适应性免疫。已经表明,限制细胞内病原体,调节先天炎症反应如炎性活化,影响淋巴细胞的代谢,以及促进抗原呈递至T细胞。研究人员已经通过抑制或对主要组织相容性复合体(MHC)类促进抗原呈递证明自噬机械的适应性免疫过程中的参与I和II类分子。自噬过程中涉及的分子机制需要高度自噬相关蛋白(ATG)的活性,以形成称为自噬体的双层膜囊泡,并传递至溶酶体降解,这一分子机制现已广为人知。到目前为止,自噬体的产生涉及三种主要的蛋白质复合物。最上游是ULK1 / 2复合物,饥饿时,其激酶活性是激活III类PI3-激酶(PI3K)复合物所必需的,其中包括核心蛋白VPS15,VPS34和Beclin-1。活化的激酶VPS34负责在自噬小体形成位点(通常在内质网)产生磷脂酰肌醇3-磷酸(PI(3)P)标记,从而允许下游自噬蛋白的募集。几种ATG蛋白(例如WIPI和ATG16L1)有助于募集自噬体生成中的最后一个复合物:ATG8 / LC3缀合复合物,由ATG5,ATG12和ATG16L1组成。这种复合物会在泛素样反应LC3A / B / C,GABARAP,和GABARAPL1 / 2(酵母ATG8直向同源物)不是针对蛋白质,而是针对形成的自噬小体膜中存在的脂质磷脂酰乙醇胺,进而在该位点介导货物募集和自噬小体伸长。
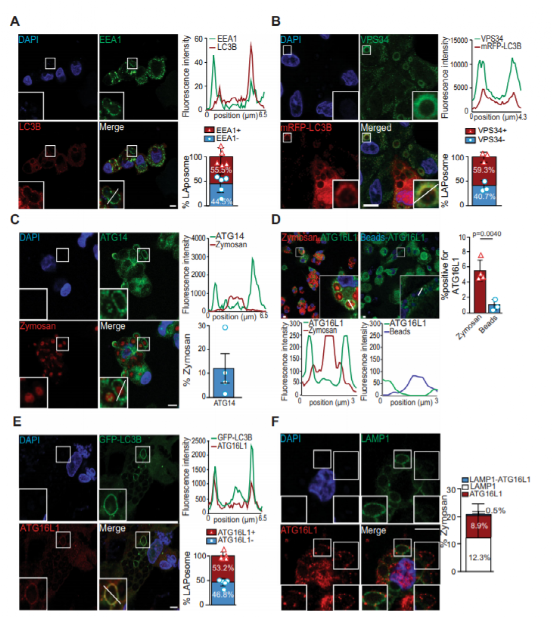
图1: VPS 34/ATG 14和ATG16L1复合物被募集到染色体上。
由此,用LC3蛋白标记的膜导致从头自噬体形成。LC3家族成员的这种膜结合取决于半胱氨酸蛋白酶ATG4。酵母ATG4的四种直系同源物存在于哺乳动物细胞(ATG4A-D)中,并通过释放C端甘氨酸120(LC3-I形式),使其脂化(LC3-II形式)到自噬体膜上来处理前LC3蛋白。除加工LC3前体外,ATG4在这些蛋白的脱结合中也起着至关重要的作用。
有趣的是,自噬的非经典形式,被称为LC3相关吞噬作用(LAP),也已经被描述参与广泛的细胞过程,包括免疫调节和炎症反应的。LAP独立于ULK1 / 2复合物,但似乎需要ATG8 / LC3共轭复合物,其特征是LC3B附着在吞噬体膜的胞质侧。这导致形成由LC3装饰的单膜囊泡,称为LAPosome。LAP通过接合和细胞表面受体的后续吞没,包括Toll样受体2(TLR2)激活,dectin-1的,的FcR或TIM-4。这些受体识别各种配体,例如垂死的细胞,免疫复合物和病原体部分,从而触发ATG蛋白子集的激活,从而使LC3B与吞噬体结合,最终与溶酶体融合。尽管LAP发生在广泛的组织和细胞类型中,但该途径的结果取决于细胞类型。目前看来,在小鼠骨髓细胞(巨噬细胞),LAP促进与溶酶体LAPosomes融合加速病原体清除,而在小鼠浆细胞样树突细胞,LAP重定向内吞货物TLR9含有核内体。然而,在人类巨噬细胞和常规树突状细胞中,LAP稳定并维持抗原,导致延长的II类MHC呈递。LAP与自噬共享各种关键调控因子,但分子机制也有所不同。之间的差异,产生活性氧类别(ROS)由NADPH氧化酶2(NOX2)是专门需要LAPosome形成。NOX2负责巨噬细胞吞噬体成熟过程中的ROS产生和pH调节,以成功控制感染。ROS如何产生,特别是NOX2如何促进LAPosome形成尚不清楚。因此,研究人员旨在阐明NOX2通过哪种机制支持LAP。最近已经表明,ATG16L1的WD40域支持LC3的脂化,因此,其附着到吞噬体外膜在NOX2独立的方式。
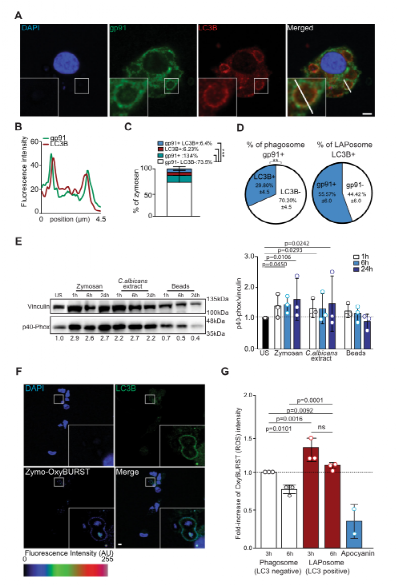
图2:脂质体内升高的活性氧水平维持数小时
在这项工作中,研究人员证明了在成熟过程中受阻的LAPosomes被NOX2装饰,并呈现出高而持续的ROS产生。研究人员还显示,蛋白酶ATG4B的LC3脱脂活性受到氧化还原调节,即靠近活性位点的关键半胱氨酸残基的氧化导致ATG4B脱脂活性失活,并废除脂质体的维持。这些发现表明,NOX2衍生的ROS产生抑制LC3B从膜上脱脂的作用使LAPosomes稳定并有利于LAPosome货物的MHC II类延长呈递。与一项研究一起证明自噬小体形成过程中ULK1抑制ATG4的研究,这项工作表明ATG4B有助于自噬和LAP期间LC3蛋白脂化的膜特异性。
LAP股它的一些分子机制与自噬,但也有像ROS产生一些独特的要求。除了提出的在脂质体形成过程中NOX2介导的ROS产生的作用外,研究人员还强调了NOX2对其稳定的作用。在这里,研究人员报告在病原体吞噬LAPosome的依赖NOX2的ROS产生抑制了来自LAPosome膜的ATG4B介导的LC3B脱脂作用,从而阻止了其成熟。这似乎使LAPosomes能够有效地将II类MHC限制呈递的抗原递送至CD4 +T细胞。有趣的是,研究人员观察到与LAPosomes紧密相关的升高和持续的氧化水平与ATG4B氧化及其聚集有关,这与之前在绿藻C. reinhardtii 中的观察结果一致。最有可能的是,ATG4B仅在紧靠胞质脂质体表面时才会被氧化,因为NOX衍生的ROS进入胞质溶胶(即通过水通道蛋白的H 2 O 2)在被大量硫醇过氧化物酶清除之前只能传播很短的距离。此外,有报道称ATG4B的半胱氨酸,靠近它的催化位点,是自噬过程中最氧化还原敏感半胱氨酸。沿着这些思路,研究人员证实半胱氨酸似乎也是氧化和抑制ATG4B(与LAPosome稳定有关)的最敏感位点。通过使用对氧化不敏感的突变体ATG4BC78S,研究人员证明了未抑制的ATG4B有效地从脂质体中去除了LC3B,从而损害了吞噬抗原的MHC II类呈递,并阻碍了人类巨噬细胞维持LAP依赖性抗原呈递。研究人员的结果将LAP的NOX2依赖性与ATG4B的氧化还原调节联系起来,作为稳定LC3B在LAPosome膜上的机制。
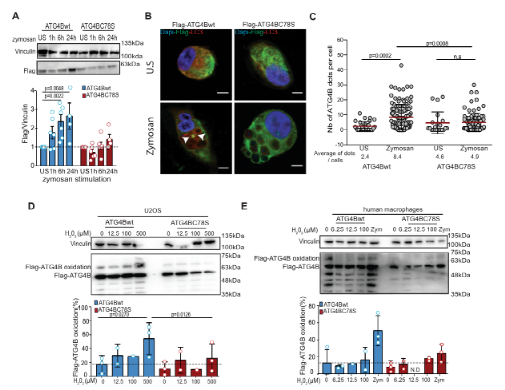
图3:活性氧对ATG4B脱脂活性的调节参与了脂质体的稳定。
自噬蛋白对吞噬作用的调节在免疫应答的几个水平上都起着作用。通过促进含病原体的吞噬体与溶酶体的融合,LAP对抗菌素免疫至关重要。确实,LAP限制了巨噬细胞中单核细胞增生李斯特氏菌的感染,然后它们才能从吞噬体中逃逸出来。据报道,β2整合素Mac-1可介导单核细胞增生李斯特氏菌对该细胞的内在免疫限制。LAP还显示出参与自身免疫性疾病的调节。LAP对垂死细胞和凋亡小体的清除效率低下,可加剧炎症过度,导致系统性红斑狼疮。此外,缺乏LAP的微生物群来源的外膜囊泡的MHC II类表现不足也被认为会导致调节性CD4 + T细胞丢失,并导致肠道过度炎症。同样,在没有LAP的情况下,肿瘤微环境中的过度炎症会促进T细胞介导的癌症免疫控制。因此,在先天免疫反应过程中,LAP可促进病原体清除并抑制过度炎症。ATG蛋白还调节的内吞作用,这反过来又影响既MHC I和MHC II限制性抗原呈现给CD8 +和CD4 +分别,T细胞,并且对适应性免疫应答的效果。与这些先前的发现一致,研究人员的数据表明,NOX2介导的对ATG4B脱脂的抑制活性有助于维持LAP,以实现更有效的II类MHC表现。此外,NOX2在延迟吞噬体的酸化中起作用,以增强I类MHC分子向CD8 + T细胞的抗原交叉呈递。
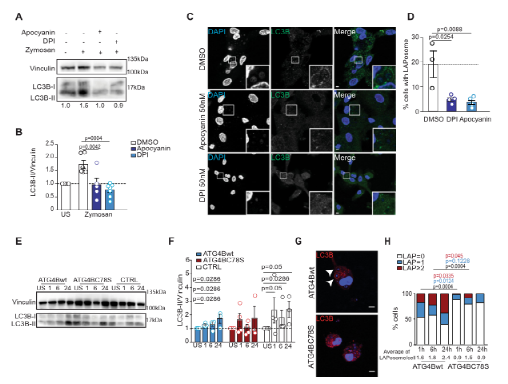
图4 :ATG4B在LAP过程中受半胱氨酸氧化调节
研究人员的发现还阐明了LC3脂质化的膜特异性。Yoshinori Ohsumi的实验室已经在早期研究中,使用ATG4缺陷型酵母,以ATG4加工的ATG8-I形式过表达酵母LC3直向同源物ATG8,表明除自噬体外,ATG8还可以存在于内体和空泡中,需要ATG4来回收ATG8。为了促进自噬体的生物发生,ATG4组成性地解离所有子宫内膜的ATG8,以维持未脂化的ATG8池。这表明LC3脂化作用对自噬膜不是选择性的,并且可能在所有PI(3)P修饰的膜上都有一定程度的扩展。在这方面,研究人员观察到在人类巨噬细胞中,PI(3)激酶VPS34与LC3B同时存在于含有病原体的吞噬体中,与先前的观察一致。此外,还显示出ATG1(酵母ULK1直向同源物)介导的ATG4磷酸化抑制了形成的自噬体上的ATG8解偶联,并且需要在该膜上维持ATG8脂质化,这对于自噬体的形成至关重要。最近的一项研究还确定了脂质体LC3解偶联的新调控层。实际上,TBK1对LC3C和GABARAPL2的磷酸化阻碍了ATG4的结合和裂解,以维持自噬体向溶酶体的单向流动。此外,研究人员的数据描述了ROS在LAP期间通过抑制ATG4B脱脂活性的支持作用。因此,LC3共轭似乎发生在比自噬小体和LAPosomes多得多的膜上,但是ATG4B在这些位点抑制LC3的共轭作用使相应的囊泡可以使用其LC3装饰的膜来调节其命运。
LAP有助于细胞内在的,先天的和适应性免疫,并需要NOX2抑制ATG4B脱脂活性,以维持LC3B在含病原体的吞噬体膜上的结合,从而允许初级人类巨噬细胞延长MHC II类抗原的呈递。LAP对免疫反应的这些有益特征可在将来利用,例如通过用自噬诱导肽刺激包含Beclin-1的PI(3)激酶复合物来改善吞噬体膜的NOX2装配,从而稳定脂质体并促进持续的MHC II类抗原呈递。
原文链接:
https://doi.org/10.1038/s41467-021-21829-6














