近日,来自哈佛医学院布莱根妇女医院的Joseph V. Bonventre研究团队在Cell Metabolism 杂志上发表了题为KIM-1 mediates fatty acid uptake by renal tubular cells to promote progressive diabetic kidney disease的研究文章,揭示了KIM-1促进糖尿病肾病进展的具体分子机制。

作者首先利用肾脏活检比较了DKD患者与早期肾小球局限性疾病患者体内KIM-1的表达量,发现KIM-1在DKD患者的近曲小管细胞中是高表达的,另外,在KKAy小鼠 (一种2型糖尿病模型鼠,具有与DKD患者相似的表型) 中作者也观察到类似的现象。这说明KIM-1在肾脏出现损伤时的确是被上调的。
那么上调的KIM-1在DKD的进展中又发挥什么作用呢?作者早先的工作揭示了KIM-1可以介导PTC对于氧化型低密度脂蛋白 (ox-LDL) 的吸收【4】,提示KIM-1可能是一种清道夫受体 (Scavenger receptor)。因此,作者分离了人原代肾小管表皮细胞并进行体外培养,他们发现这些原代细胞会摄取培养基中结合棕榈酸的白蛋白 (PA-BSA),但不会吸收非酯化的白蛋白。而敲低KIM-1则会显著抑制细胞对于PA-BSA的吸收。有意思的是,作者发现KIM-1只会增加PTC对于PA-BSA的摄取,不会促进其他脂肪酸结合的白蛋白的吸收,如OA-BSA(18:0)和LA-BSA(18:1)。这些实验结果表明KIM-1会特异性的介导了PTC对于PA-BSA的吸收。
那么PA-BSA的摄取增加是否是推动DKD进展的“黑手”呢?进一步的研究结果表明KIM介导的PA-BSA的吸收增加会导致肾小管上皮细胞的凋亡,并且会诱导细胞内多种应激反应的出现,例如ROS水平的升高,炎症因子 (如TNF-α,IL-6, IL-1β) 的产生,DNA损伤修复通路 (DDR) 的激活以及细胞周期的阻滞,而这些应激反应共同驱动了肾脏的纤维化和炎症反应。进一步,作者在马兜铃酸 (aristolochic acid) 和STZ诱导的肾损伤和DKD模型小鼠中也再次验证了细胞实验中所观测到的现象,更为重要的是,他们发现KIM-1功能缺失 (KIM-1Δmucin) 的糖尿病模型小鼠更不容易发展成DKD的表型。
最后,作者采用了一种高通量的筛选方法从14430小分子化合物中成功筛选到12个潜在的KIM-1抑制剂,其中TW37是最有潜力的一个。TW37最初被报道是bcl-2的抑制剂。于是作者分别在细胞中和DKD模型小鼠体内对TW37的功能展开了验证。他们发现TW37可以有效抑制KIM-1介导的PA-albumin的吸收,从而阻止肾小管上皮细胞的凋亡、炎症反应以及纤维化进程,最终抑制DKD的进展。
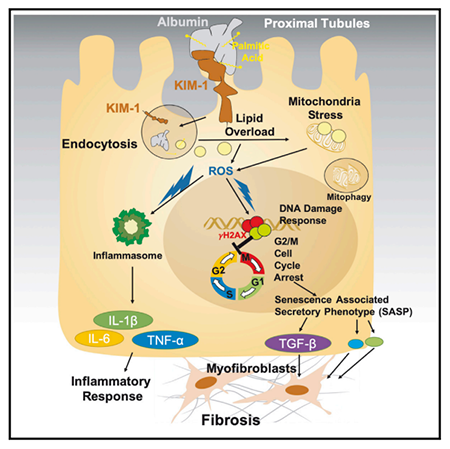
总的来说,该研究团队围绕KIM-1与DKD致病机制做了非常系统的工作。例如,他们是最早鉴定出KIM-1作为肾近曲小管损伤标志物的研究团队【1,2】,另外他们前期的工作揭示了KIM-1的表达升高会推动DKD向ESKD的演变【3-5】。而这项工作则为KIM-1在DKD的病理生理学中的具体机制提供了一个科学的解释,同时的他们的研究结果显示KIM-1可作为干预DKD进展的一个非常有潜力的药物靶点。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(21)00170-4













