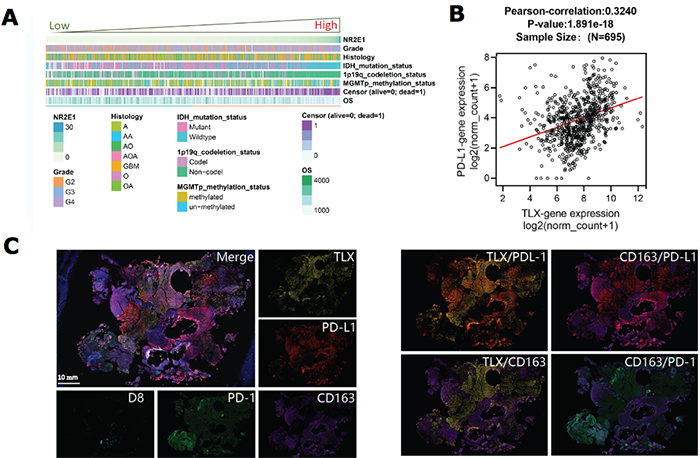
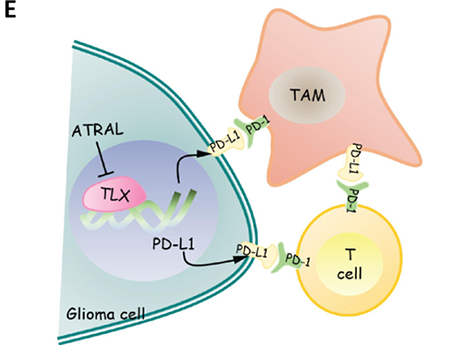
核受体(Nuclear receptor)家族是国际公认的药物靶标。核受体功能异常与癌症、代谢性疾病等多种疾病的发生发展直接相关。据统计,在现有临床药物中,核受体靶向药物占全球医药市场的10-15%。在抗肿瘤领域,核受体靶向药物在癌症的治疗中取得巨大成功,如雌激素受体靶向药物他莫昔芬、雄激素受体靶向药物恩杂鲁胺等。因此,针对核受体发掘肿瘤新靶点将为抗肿瘤创新药物研发提供新的源头,对研发具有自主知识产权创新药物具有积极意义。胶质瘤是颅内高发肿瘤,高级别胶质瘤恶性程度高、易复发且预后不良,胶质母细胞瘤(GBM)五年平均生存期低于5%。近年来,免疫治疗在恶性胶质瘤上做了非常积极的探索,如免疫检查点抑制,CAR-T细胞治疗和肿瘤新抗原疫苗等,但胶质瘤特殊的免疫抑制微环境带来很大的挑战。因此,探究胶质瘤的免疫微环境调控机制对改善其免疫治疗疗效至关重要。已有报导显示GBM组织表达PD-L1,为胶质瘤免疫检查点PD-1/PD-L1治疗提供了理论基础【1】。针对PD-1/PD-L1靶点的一系列临床研究也显示单抗治疗对复发GBM的临床获益有限,但仍是有希望的方向【2】。研究PD-L1在肿瘤细胞中的调控机制对提高PD-1/PD-L1的治疗效果和改善耐药具有重要意义。然而,胶质瘤细胞表面PD-L1的水平如何受到调节,其表达如何进一步影响肿瘤控制和预测治疗反应,目前尚不清楚。近期,南方医科大学深圳医院临床医学创新中心吴丁兰团队在The Journal for Immunotherapy of Cancer上发表题为Orphan nuclear receptor TLX promotes immunosuppression via its transcriptional activation of PD-L1 in glioma 的研究论文。该研究首次揭示了孤儿核受体TLX在胶质瘤免疫微环境调控中的重要功能,阐明了TLX转录激活PD-L1的分子机制,提出了TLX拮抗剂联合PD-1抗体抑制胶质瘤的新策略,为恶性胶质瘤联合免疫治疗提供了新方向。核受体TLX参与脑肿瘤发生发展,主要与神经干细胞的自我更新相关,但之前的研究均为小鼠转基因模型上的探讨【3】。此研究从临床胶质瘤出发,研究了TLX与胶质瘤免疫微环境和PD-L1的表达关系,证明了TLX高表达与胶质瘤免疫抑制微环境、IDH分子分型和不良预后有关。脑胶质瘤的免疫微环境由肿瘤细胞、免疫细胞(包括巨噬细胞、小胶质细胞、 髓系来源抑制性细胞MDSC、调节性T细胞Treg、NK细胞)及其分泌的各类因子等组成。相比于其他实体肿瘤,脑胶质瘤具有独特的免疫微环境【4】。在胶质瘤组织中,小胶质细胞和肿瘤相关巨噬细胞(统称为GAM)是胶质瘤微环境中数量最多的免疫细胞,约占肿瘤实体的一半。有意思的是,有研究发现肿瘤相关巨噬细胞(TAM)表面除了表达PD-L1(与肿瘤细胞共同形成对T细胞的免疫抑制),同时还表达PD-1,且阻断巨噬细胞上的PD-1能显著增强TAM的吞噬功能,减缓肿瘤的生长【5】。该研究通过全景免疫荧光染色的方法,发现TLX主要在肿瘤细胞(而非免疫细胞)上表达,并证实了PD-L1在肿瘤细胞和TAM上阳性染色,同时证明了PD-1不仅会在出现在TILs上也会出现在CD163+TAM上,表明胶质瘤细胞上的PD-L1能与TAMs与TILs上的PD-1结合介导免疫抑制。进一步研究发现,将TLX敲除的鼠胶质瘤细胞皮下或颅内种植至免疫功能完善的小鼠体内,肿瘤生长减慢,肿瘤中浸润的CD4+ T、CD8+ T细胞增加,而PD-1+T和CD206+ M2 TAMs浸润细胞减少,表明抑制TLX能通过恢复胶质瘤免疫微环境抗肿瘤活性进而抑制体内肿瘤生长。同时,新近发现的TLX抑制剂ATRAL可以显著抑制胶质瘤生长。该研究还明确了TLX调控PD-L1转录活性的分子机制。综上,这项研究发现TLX能通过转录激活PD-L1的表达介导胶质瘤的免疫抑制微环境从而促进肿瘤的恶性进展,肿瘤细胞上升高的PD-L1能与TAMs和TILs上的PD-1结合介导免疫抑制,联合靶向核受体TLX有利于改善胶质瘤的免疫治疗效果。该项研究的第一作者和通讯作者均来自南方医科大学深圳医院,研究生周嘉懿、病理科裴小娟教授,博士后杨英桂为共同第一作者,通讯作者为临床医学创新中心吴丁兰副研究员、李欣研究员、神经外科毛捷教授。该项研究是基础研究、病理科和神经外科团队紧密合作成果,对恶性胶质瘤新药物开发具有重要意义。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8055120/1. Sophie B A , Barbara K , Georg W , et al. Programmed death ligand 1 expression and tumor-infiltrating lymphocytes in glioblastoma[J]. Neuro-Oncology, 2015.2. Cloughesy T F , Mochizuki A Y , Orpilla J R , et al. Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma[J]. Nature Medicine, 2019.3. Zhu Z, Khan MA, Weiler M, et al. Targeting self-renewal in high-grade brain tumors leads to loss of brain tumor stem cells and prolonged survival.[J]. Cell Stem Cell, 2014.4. Friebel E , Kapolou K , Unger S , et al. Single-Cell Mapping of Human Brain Cancer Reveals Tumor-Specific Instruction of Tissue-Invading Leukocytes[J]. Cell, 2020.5. Gordon S R , Maute R L , Dulken B W , et al. PD-1 expression by tumor-associated macrophages inhibits phagocytosis and tumor immunity[J]. Nature, 2017.