自21世纪以来,先后发生了3次由冠状病毒引起肺炎的全球性流行病,分别是2003年的严重急性呼吸综合征(Severe Acute Respiratory Syndromes,SARS)、2012年的中东呼吸综合征(Middle East Respiratory Syndrome,MERS)和2019年的新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)。尤其是此次新冠疫情,在全球范围内已经造成超过2亿人感染,其高传染性和高隐蔽性已对全球人类健康和经济等造成了严重的威胁。随着疫情的发展,多种新冠病毒突变体在世界各地出现,可能导致康复者血清或新冠疫苗接种者血清的中和能力下降。同时,狡猾的新冠病毒在进化过程中把自己伪装起来,人体免疫系统和病毒进入一个微妙的相持阶段,导致无症状感染者持续增加,这给新冠肺炎疫情防控带来巨大挑战。
2021年9月24日,上海交通大学瑞金医院呼吸与危重症医学科瞿介明教授、瑞金医院上海血液学研究所诸江教授和上海公共卫生临床中心卢洪洲教授合作在 Cell Research 发表题为Distinct immune signatures discriminate between asymptomatic and presymptomatic SARS-CoV-2subjects 的论文。该研究通过整合质谱流式技术(CyTOF)、转录组测序(RNA-seq)和血浆微量蛋白的Olink检测技术,首次揭示区分持续无症状感染者和潜伏期无症状感染者的主要免疫学特征,并结合其临床特征,发现了影响SARS-CoV-2感染者在SSIS时期疾病朝不同方向进展的关键免疫机制,在此基础上鉴定出采用简单的ELISA检测手段即可实现的标志物,并在另一队列中验证了其可行性,为临床工作中早期识别出潜伏期无症状感染者,以及在更早的阶段对其进行及时干预并阻断其进展为确诊患者提供理论依据。

本研究联合使用CyTOF、RNA-seq和OIink技术对年龄、性别相当,无明显免疫异常的并发症的19名持续无症状感染者、12名潜伏期无症状感染者、47名轻型或普通型COVID-19患者以及27名健康志愿者的外周血标本进行联合分析,揭示了可以区分持续无症状感染者和潜伏期无症状感染者特有的免疫学变化。
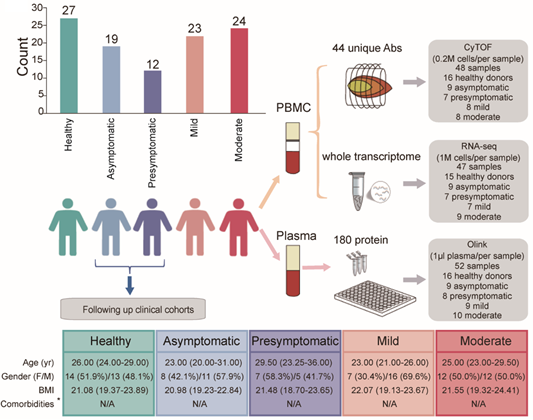
通过CyTOF技术深入分析38个免疫细胞表面分子标志物的表达谱,鉴定了包括NK细胞、CD3+T细胞、B细胞、树突状细胞、单核细胞和中性粒前体细胞在内共35个细胞亚群。发现与持续无症状感染者相比,潜伏期无症状感染者CD62Lhi CD8+ Tnaïve细胞比例明显下降,MAIT比例有下降趋势,而CD4+ CD161hi NKT细胞比例上升,而已有文献报道CD8+ Tnaïve细胞与MAIT数量随着COVID-19的病情进展而逐渐减少,这可能与细胞的过度活化有关;而相较于健康对照组,持续无症状感染者CD8+ Tnaïve细胞和MAIT比例基本不变,边缘区B细胞亚群增多,NKT细胞亚群不变,淋巴细胞的CD44表达上调、PD-1表达下调,推测这种免疫应答模式可能有助于形成保护性免疫,避免出现免疫耗竭。
在单核细胞方面,发现与健康对照组相比,潜伏期无症状感染者和轻型、普通型COVID-19患者的CD107alow经典型单核细胞、过渡型单核细胞和非经典型单核细胞均减少了,而持续无症状感染者只有中间型和非经典型单核细胞明显减少。进一步分析发现CD107ahigh与CD107alow经典型单核细胞的比值在潜伏期无症状感染者和轻型、普通型COVID-19患者组别中相较于健康对照组和持续无症状感染者明显增高,两者比值增高反映单核细胞处于过度活化状态;另外还发现潜伏期无症状感染者CD107alow经典型单核细胞向过渡型和非经典型单核细胞分化受阻。由此可见,与持续无症状感染者相比,潜伏期无症状感染者存在单核细胞过度活化和分化阻滞的现象。
通过RNA-seq技术,进一步验证了单核/巨噬细胞活化、分化和功能异常与处于SSIS感染者疾病进展方向密切相关。具体而言,单核/巨噬细胞的浸润、功能激活和分化潜能,NF-kB信号通路的活化,与持续无症状感染者正相关;而I型干扰素信号通路、病毒复制抑制、抗原提呈、TNF和IFNγ信号通络、免疫缺陷、淋巴细胞耗竭、NKT信号通路,以及SARS-CoV相关病毒的感染反应,与潜伏期无症状感染者显著正相关。此外,与持续无症状感染者相比,潜伏期无症状感染者单核细胞/巨噬细胞和抗病毒功能相关基因FAM110B、PPP1R17、CTDSPL和NOX1表达下调。相比之下,I型干扰素刺激基因如XAF1、IFI44、IFI44L、LAMP3、RSAD2、MX1和USP18以及免疫抑制基因包括SPP1、UTS2、EGR3和P2RY6在潜伏期无症状感染者中显著上调。值得注意的是,促炎基因如CCR5、PAK3和LPAR3在潜伏期无症状感染者中富集,而抗炎基因IL12B在持续无症状组中更富集,表明促炎基因激活和免疫抑制之间可能存在因果关系。
此外通过Olink技术系统全面的检测了外周血血浆蛋白种类,发现包括与单核细胞相关的MMP-1, CLEC4A, LY75和STC1在内共7种炎症因子在持续无症状感染者和潜伏期无感染者中存在差异。与持续无症状感染者不同的是,潜伏期无症状感染者中MMP-1水平较健康者增高,而STC1水平明显下降,对结果进行相关性分析后发现MMP-1与单核细胞功能标志物CLEC4A、LY75水平呈负相关;相反的,STC1与二者呈正相关。根据其他文献报道,STC1是限制单核细胞活化的关键因子之一,可以抑制MCP-1促进非经典型单核细胞活化和迁移的作用,同时也是MMP-1负调控因子。进一步分析发现STC1水平与CD107alow经典型、过渡型和非经典型单核细胞的比例呈正相关,并通过实验验证了STC1在单核细胞分化中的关键作用。
考虑到研究成果可以更好的应用到实际临床诊断中,后续使用ELISA方法验证了Olink实验中发现的两种关键因子STC1和MMP-1。为了进一步检验ELISA方法的可行性和结果的可靠性,还对另一个全新的SSIS队列中持续无症状感染者和潜伏期无症状感染者血浆标本中STC1和MMP-1水平进行检测,发现使用ELISA方法检测SSIS感染者血浆中这两种因子水平可以较好的将两种无症状感染者区分开,帮助临床中早期识别出潜伏期无症状感染者,从而对患者进行及时干预,改变病程转归,减轻疾病严重程度,进一步降低死亡率。
该项研究聚焦目前广受关注的新冠无症状感染问题,通过对SSIS队列的研究,发现相较于持续无症状感染者,潜伏期无症状感染者外周免疫细胞中CD107alow经典型单核细胞、过渡型单核细胞、非经典型单核细胞以及CD62Lhi CD8+ Tnaïve细胞比例均下降,并且血浆蛋白中STC1也是减少的,而 CD4+ NKT细胞比例是上升的;进一步分析后还发现潜伏期无症状感染者存在单核细胞过度活化和分化抑制的现象,这一现象可能与淋巴细胞耗竭和免疫阻滞相关,揭示了导致SSIS两种截然不同的进展方向的免疫机制,有助于进一步了解SARS-CoV-2感染引起的免疫特征,为临床工作中早期识别出潜伏期无症状感染者,以及在更早的阶段对其进行及时干预并阻断其进展为确诊患者提供理论依据。
据悉,上海交通大学瑞金医院呼吸与危重症医学科瞿介明教授、瑞金医院上海血液学研究所诸江教授和上海公共卫生临床中心卢洪洲教授为论文共同通讯作者。国家转化医学中心(上海)余山河助理研究员、呼吸与危重症医学科邸彩霞主治医师、上海血液研究所陈仕俊博士研究生、呼吸与危重症医学科颜佳扬博士研究生为论文的共同第一作者。
原文链接:https://www.nature.com/articles/s41422-021-00562-1
参考文献
[8] Silvin A, Chapuis N, Dunsmore G et al. Elevated Calprotectin andAbnormal Myeloid Cell Subsets Discriminate Severe from Mild COVID-19. Cell 2020; 182:1401-1418.e1418.
文章来源:bioart













