近日,来自伦敦CRUK基因功能实验室等单位,Christopher J. Lord等的研究团队共同在Nature Cell Biology杂志发表了题为The ubiquitin-dependent ATPase p97 removes cytotoxic trapped PARP1 from chromatin 的研究工作,通过临近标记等方法鉴定了PARP1在基因损伤位点的互作蛋白,发现捕获状态下的PARP1可发生SUMO化和泛素化,继而通过VCP/p97将其从染色体上解除捕获状态。p97抑制剂与PARPi联用可明显延长PARP1的捕获状态,增加细胞对药物的敏感性。

为研究PARP1在形成捕获状态时的复合体组成,研究人员选用CAL51 PARP1–/–细胞系,引入野生型PARP1(PARP1WT)基因和捕获缺失突变体PARP1(PARP1del.p.119K120S),并通过甲磺酸甲酯(MMS)为DNA损伤诱导剂和talazoparib为PARPi进行药物处理。为进行特异性富集,研究人员采取两种策略对其互作蛋白进行鉴定:1)融合eGFP PARP1进行免疫共沉淀富集;2)经Apex2融合后通过临近标记技术进行生物素富集。
通过这两种富集方法和质谱鉴定,研究人员发现捕获状态的PARP1互作蛋白内存在较高丰度的SUMO1、SUMO2蛋白,并在GO分析中可见有泛素化修饰通路富集,提示泛素和类泛素化修饰可能参与调控PARP1捕获状态。通过经典的泛素化和SUMO化检测,研究人员验证捕获状态下的PARP1可先后发生SUMO化和泛素化修饰。既往文献已报道SUMO化的连接酶 PIAS4和泛素化的连接酶RNF4可修饰PARP1,研究人员利用细胞系验证敲除PIAS4和RNF4后可减弱PARP1的SUMO和修饰,并减缓了PARP1捕获状态的解除。
研究人员在互作蛋白内鉴定到VCP/p97蛋白复合体成分,并验证了在捕获状态下,p97与PARP1存在明显的互作和共定位。p97是泛素化-蛋白酶体通路中重要的ATP水解酶,以复合体形式与UFD1及NPL等蛋白协作,识别泛素化修饰的底物将其从膜结构或者聚集状态中分离出来,进一步促进其泛素化降解。既往研究也已发现,细胞核内的p97可将蛋白从染色体中分解出来,可降解或者再次循环利用。通过对经MMS和talazoparib处理后的细胞的PARP1捕获状态进行定量分析,发现p97抑制剂(CB-5083、CuET)处理或过表达p97突变体均可抑制其解除捕获状态。利用DNA损伤常用的指标分子γH2AX和RAD51也可发现,p97抑制剂可明显增加处理后细胞的DNA损伤指标。
最后,研究人员利用细胞模型进行肿瘤功能上的验证,证实PARPi与p97抑制剂联用可明显增加肿瘤细胞毒性,且该效应依赖于PARP1。为验证该联用策略可在肿瘤治疗中收益,研究人员利用小鼠和患者来源的肿瘤类器官进行药效评价,发现p97抑制剂可明显增加存在BRCA功能障碍的肿瘤类器官对PARPi的敏感性。
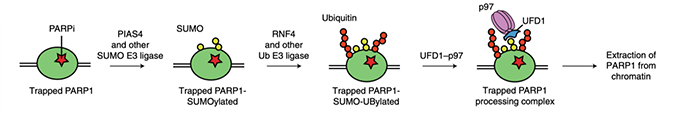
这项研究利用生物化学方法获得捕获状态的PARP1和其互作蛋白,并发现了SUMO化、泛素化过程及p97功能对其捕获状态的调控作用。通过p97抑制剂与PARPi联用处理可抑制PARP1解除捕获状态,研究人员证实这种联用策略可增加肿瘤细胞毒性,特别是存在DNA损伤修复通路障碍的肿瘤中具有明显抑制效果。该研究赋予了p97在DNA损伤修复和肿瘤治疗中的新功能,拓展了p97抑制剂在肿瘤治疗中的应用。
原文链接:
https://doi.org/10.1038/s41556-021-00807-6













