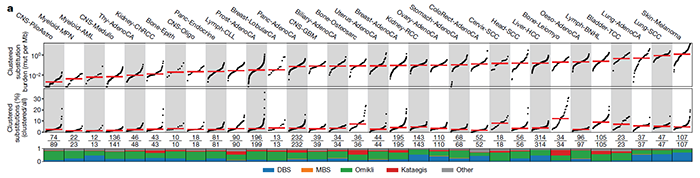
2022年2月9日,Ludmil Alexandrov 团队在 Nature 期刊发表题为:Mapping clustered mutations in cancer reveals APOBEC3 mutagenesis of ecDNA(癌症聚集突变的定位揭示了APOBEC3突变的ecDNA)的研究论文。该研究绘制了已知的聚集性体细胞突变最全面、最详细的图谱,揭示了染色外DNA(ecDNA)中胞嘧啶脱氨酶APOBEC3的突变特征,并将这种新的聚集性体细胞突变模式命名为Kyklonas(希腊语旋风),这种突变模式是癌症进化中一个之前未被认识到的关键角色,它们导致了约10%的人类癌症的发展,并可用于预测癌症患者的生存和治疗。Ludmil Alexandrov 教授表示,通常体细细胞会随机发生基因组突变,但仔细观察这些突变时,发现它们往往发生在一些热点区域。
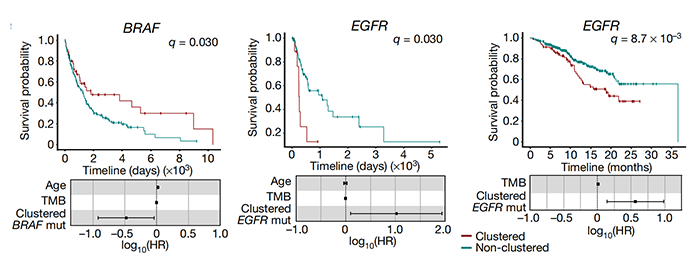
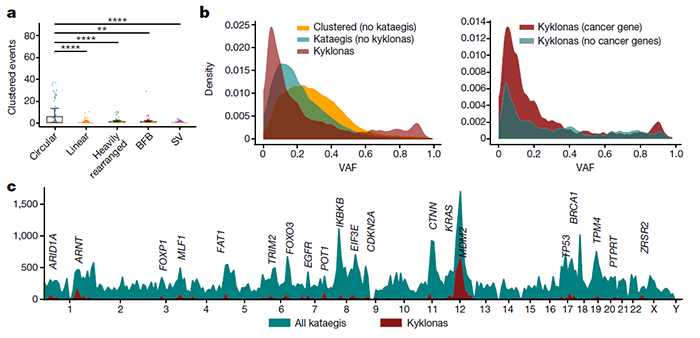
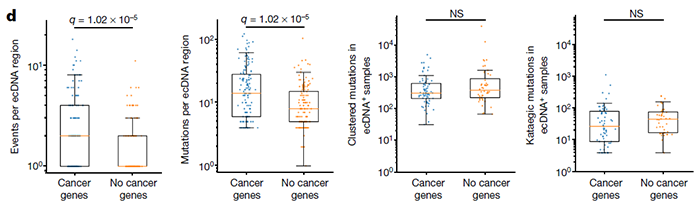
然而,一直以来,聚集突变在很大程度上被忽视了,因为它们只占所有突变的很小比例。但是通过深入研究,研究团队发现它们在人类癌症的病因中起着重要作用。在此之前,科学家们对聚集性体细胞突变的分析主要集中在单碱基替换上,揭示了几种类型的聚集事件,包括双碱基替换(DBS)和多碱基替换(MBS)、omikli突变(希腊语迷雾)和kataegis突变(希腊语阵雨)。而这篇 Nature 论文,包括了30种不同癌症类型的2583名癌症患者的全基因组测序数据,涵盖了碱基替换和聚集性插入和缺失突变。研究团队绘制了已知的聚集性体细胞突变最全面、最详细的图谱。研究团队开发了下一代人工智能方法创建了这一图谱,然后,他们使用这些算法来检测个体患者中的聚集突变,并阐明导致这些事件的潜在突变过程。通过这些,他们发现,在大约10%的人类癌症中,聚集性体细胞突变有助于癌症的发展。不仅如此,研究人员还发现,一些癌症驱动基因群——特别是那些已知的癌症驱动基因,可以用来预测患者的总体生存率。例如,BRAF基因(黑素瘤中最广泛观察到的驱动基因)聚集突变的存在,比非聚集突变的个体更有利于患者的总体生存。与之相对,EGFR基因(肺癌中最广泛观察到的驱动基因)的聚集突变则导致患者生存期下降。该论文的第一作者 Erik Bergstrom 博士表示,这是一个十分有趣的现象,我们看到不同的聚集突变能产生不同的生存率,而这些基因都是可以进行临床检测的。因此,这是一种非常简单和精确的、可以预测患者生存率的生物标记物。BRAF基因的聚集突变提高患者生存率,而EGFR基因的聚集突变则导致患者生存期下降研究团队进一步分析了引起聚集性体细胞突变的各种因素,包括紫外线辐射、饮酒、吸烟,其中最值得注意的是一种叫做APOBEC3的抗病毒酶的活性。APOBEC3酶通常存在于细胞内部,作为细胞内部免疫反应的一部分。它们的主要工作是摧毁进入细胞的病毒。但如今,Ludmil Alexandrov 团队认为,在癌细胞中,APOBEC3酶可能弊大于利。研究团队发现,癌细胞具有染色体外DNA(ecRNA)的环状结构,其中含有已知的癌症驱动基因,而在单个ecDNA分子中往往存在大量的突变。研究人员将这些突变归因于APOBEC3酶的活性——APOBEC3酶误将环状的ecDNA当成外来病毒,并试图限制和切断它们。在此过程中,APOBEC3酶导致单个ecDNA分子内形成突变簇,这反过来又在加速癌症进化和可能导致耐药性方面发挥了关键作用。研究人员将这些聚集突变的ecDNA命名为“Kyklonas”,在希腊语中是“旋风”的意思。APOBEC3酶导致单个ecDNA分子内形成突变簇
Ludmil Alexandrov 教授表示,这是一种全新的肿瘤发生模式。更重要的是,这为新的癌症治疗方法奠定了基础,在未来,临床医生可以考虑限制APOBEC3酶的活性或靶向ecDNA来治疗癌症。总而言之,这项研究绘制了已知的聚集性体细胞突变最全面、最详细的图谱,并揭示了这些聚集突变可以用来预测患者的生存。此外,该研究还表明APOBEC3酶和ecDNA在癌症的进化和耐药性方面发挥了关键作用,为癌症的治疗提供了新的思路。https://www.nature.com/articles/s41586-022-04398-6