近日,美国辛辛那提儿童医院医疗中心Daniel T. Starczynowski团队在Science translational medicine期刊上发表题为 Blocking UBE2N abrogates oncogenic immune signaling in acute myeloid leukemia 的文章,研究证实失调的先天免疫通路激活发生在来自不同AML亚型的白血病HSPC中,并且在泛素结合酶E2N(UBE2N)节点会聚信号,其中一些通路与维持白血病HSPC中的致癌免疫信号状态有关。在AML细胞系、患者来源的原代AML细胞及其构建的模型小鼠中的数据表明靶向抑制UBE2N,在体外体内抑制了白血病细胞功能。

首先,作者通过数据库分析发现AML HSCs中先天免疫基因的失调与肿瘤坏死因子受体、白细胞介素-1受体、B细胞受体、RIG-I/线粒体抗病毒信号蛋白、TLR相关家族、CD40和NF-κB通路的受体激活剂相关(图1)。在确诊患者中,也发现超过30%的患者的一些先天免疫相关基因在诊断和复发时持续失调,表明先天免疫基因的失调在AML的发展和维持中可能也具有重要的作用。因此,作者试图在白血病细胞中确定致癌免疫相关信号通路和节点,并适合治疗的靶标基因。结果鉴定到了UBE2N,一种适合治疗靶向的泛素结合酶,综合评分最高,且在大多数AML细胞系中是必需的(> 12个AML细胞系中的7个)。
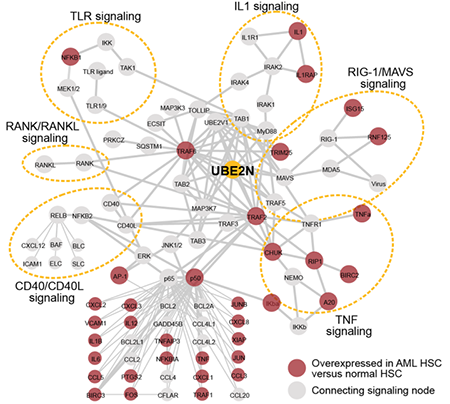
图1. KEGG通路分析在AML表型定义的白血病干细胞中失调的基因
通过shRNA敲低UBE2N的表达,导致AML细胞系和病人来源的原代AML细胞的细胞活力下降、克隆形成潜力降低以及具有细胞分化形态,但UBE2N的下调并不影响健康脐带血CD34+细胞的功能、活力或形态,动物实验也发现敲低UBE2N,使AML模型小鼠的肿瘤负荷减少,表明UBE2N表达是白血病细胞存活和功能所必需的。并且证实了UBE2N的87位半胱氨酸(Cys87)的泛素结合功能是选择性维持白血病细胞活力和功能所必需的,也表明破坏UBE2N活性是一种白血病靶向策略。
作者基于结构使用计算机虚拟筛选以及白血病细胞验证,鉴定了UBE2N的两种小分子抑制剂UC-764864和UC-76486,可以直接结合催化Cys87并抑制AML细胞中UBE2N泛素结合功能,具有细胞毒性和抑制了UBE2N依赖性信号传导的作用。进一步通过RNA-seq评估UC-764864对AML细胞的影响,发现UC-764864处理的MOLM-13细胞中的下调基因表现出 IFN信号和细胞因子信号的富集,表明抑制UBE2N功能与抑制AML细胞中免疫和炎症相关的致癌途径相关。
其次,作者在体外体内实验中测试UBE2N小分子抑制剂的功能,发现正如预期的那样,使用小分子抑制了UBE2N活性后,AML细胞系和原代AML细胞均表现不同程度的功能受损,但不影响健康CD34+细胞中的活性和功能,对AML细胞系和原代AML细胞构建的模型动物也显示出较好的抗白血病作用。
总之,本文证实AML HSPC中表现出高频率的先天免疫和相关炎症通路的失调,维持着白血病细胞的功能。通过人类AML细胞系和患者来源样本中的基因表达分析和功能研究,发现泛素结合酶UBE2N是多种免疫与炎症通路的会聚信号节点,通过维持致癌免疫信号传导状态,来促进白血病细胞功能。此外,鉴定了选择性靶向UBE2N酶活性的小分子抑制剂,在遗传和药理上抑制UBE2N,均可在体外体内消除AML HSPC功能来发挥抗AML作用。
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.abb7695













