染色质和染色体外DNA分子的动态三维结构调节着基本的细胞过程。然而,活细胞中特定DNA序列的可视化,特别是占基因组大部分的非重复序列,仍然是巨大的挑战。
2022年9月14日,西湖大学宋春青及申恩志共同通讯在Cell Research(IF=46)在线发表题为“CRISPR FISHer enables high-sensitivity imaging of nonrepetitive DNA in living cells through phase separation-mediated signal amplification”的研究论文,该研究表明CRISPR FISHer能够通过相位分离介导的信号放大,对活细胞中的非重复性DNA进行高灵敏度成像。该研究介绍了一个稳健的CRISPR介导的荧光原位杂交放大器(CRISPR FISHer)系统,该系统利用工程sgRNA和蛋白质三聚体结构域介导的、基于相分离的荧光蛋白在CRISPR靶向基因座的组装,增强了局部亮度和信号背景比,从而实现了活细胞中非重复DNA基因座的单sgRNA定向可视化。
在一项应用中,通过标记和跟踪染色体片段破裂的末端,CRISPR FISHer能够实时可视化染色体破裂、分离的整个过程,以及随后在单个活细胞中染色体内或染色体间末端重新连接的全过程。此外,CRISPR FISHer允许记录小的染色体外环状DNA (eccDNAs)和入侵DNAs的运动,揭示了染色体和染色体外基因座之间的动态行为的显著差异。CRISPR FISHer具有追踪任何特定的自我或非自我DNA序列的潜力,极大地拓宽了生物事件和生物医学诊断中的活细胞成像的范围。

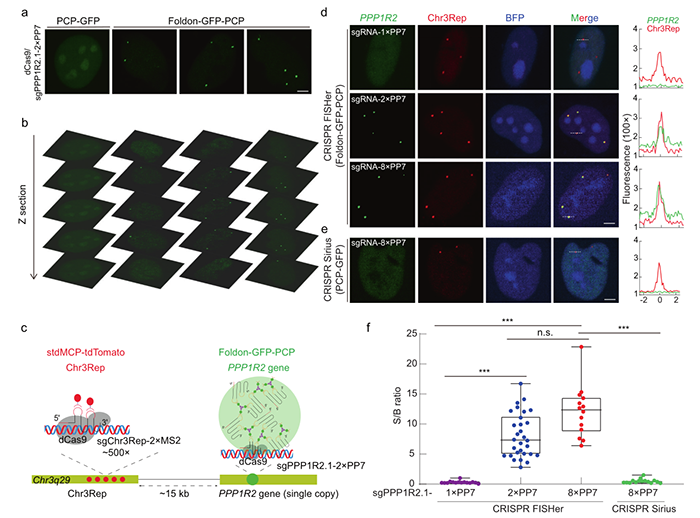
遗传物质DNA是动态和时空组织的,对基本的细胞过程及其他过程施加深刻的控制。基因组不稳定或染色体结构变异可诱导DNA损伤和修复,有时产生染色体外DNAs。此外,一些入侵者,如病毒,可以感染细胞,并将其基因组传递到细胞核,导致细胞功能障碍和疾病发展。因此,可视化核DNA的空间分布和动态,包括染色体和染色体外DNA元件,对于理解它们的生物学功能至关重要。然而,在活细胞中实时追踪任何特定的核DNA仍然具有挑战性。CRISPR FISHer 实现了内源性非重复基因组区域的可视化(图源自Cell Research )以往的研究通过整合大量人工DNA序列阵列来实现基因组成像,如LacO,它依赖于对每个感兴趣的基因座进行冗长的基因组工程,这些插入的外源序列可能会干扰目标位点并产生不可预测的副作用。最近,由于小sgRNA和靶序列中的原间隔相邻基元(PAM)引导Cas9蛋白与靶DNA结合的特异性,CRISPR系统被重新应用于活细胞内源性基因组位点的动态和三维结构成像,克服了传统荧光原位杂交(FISH)需要固定样本和变性DNA的限制。例如,荧光蛋白融合失活Cas9核酸酶(dCas9)或dCas9与sgRNA结合,募集荧光蛋白融合RNA结合蛋白,为活细胞基因组成像提供了一个很好的平台。然而,CRISPR介导的活细胞成像目前依赖于多个重复元素或沿靶位点排列的sgRNAs阵列。事实上,人类基因组中很少存在特定基因座的串联DNA重复。使用sgRNA 平铺的成像策略难以实现足够的信号与背景 (S/B) 比,这使得可视化非重复DNA序列具有挑战性,从而阻碍了CRISPR成像的广泛应用。在这里,该研究报道了一种DNA实时成像系统,CRISPR介导的荧光原位杂交放大器(CRISPR FISHer),基于相分离调节的局部信号放大,允许使用单个sgRNA实现原生非重复序列的稳健可视化,并扩展了CRISPR介导的活细胞成像的应用。https://doi.org/10.1038/s41422-022-00712-z