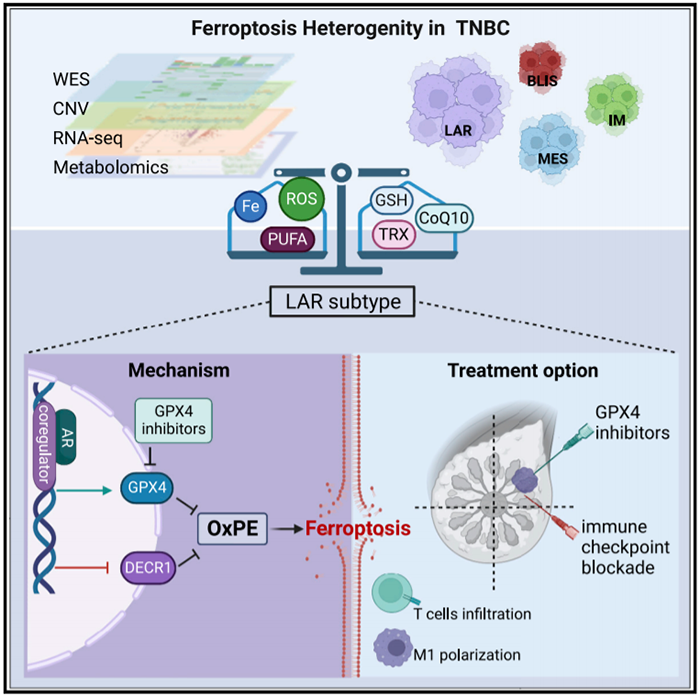
三阴性乳腺癌(TNBC)的治疗仍然具有挑战性。破译调节铁死亡的代谢途径将为TNBC治疗策略提供新的见解。2022年10月17日,复旦大学邵志敏,江一舟及Xiao Yi共同通讯在Cell Metabolism 在线发表题为“Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy”的研究论文,该研究整合了TNBC队列(n = 465)的多组学数据,开发了铁死亡图集。该研究发现TNBC在铁死亡相关代谢产物和代谢途径中具有异质表型。TNBC的腔内雄激素受体(LAR)亚型的特征是氧化磷脂酰乙醇胺和谷胱甘肽代谢(特别是GPX4)上调,这允许利用GPX4抑制剂诱导铁死亡。此外,该研究还证实了抑制GPX4不仅可以诱导肿瘤铁死亡,而且可以增强抗肿瘤免疫。GPX4抑制剂与抗PD1联合治疗效果优于单一治疗。临床上,在免疫治疗队列中,高GPX4表达与较低的溶细胞评分和较差的预后相关。总的来说,该研究展示了TNBC的铁死亡情况,并揭示了难治性LAR肿瘤的一种创新的免疫治疗联合策略。最后,在2022年7月4日,iNature编辑部总结了近4年复旦大学邵志敏团队在JCO,Cancer Cell 等发表15篇典型文章。
三阴性乳腺癌(TNBC)是一种生物学和临床异质性疾病,约占已诊断乳腺癌的15%,仍然是最难治疗的乳腺癌亚型。多组学研究为TNBC的生物学和异质性提供了新的见解,促进了精准治疗的发展。之前的工作描述了中国人群中TNBC的转录组学、基因组学和代谢组学景观,以说明它们在分子特征、代谢重编程和肿瘤微环境方面的异质性。基于这些发现,研究人员提出了一个具有四种亚型的TNBC分类系统:间充质样(MES)、腔内雄激素受体(LAR)、免疫调节(IM)和基底样和免疫抑制(BLIS)亚型。此外,研究人员还针对每个亚型提出了几个潜在的治疗靶点,并进行了FUTURE试验(ClinicalTrials.gov,编号:NCT03805399)来验证这些靶向疗法的有效性。尽管与传统化疗相比,客观有效率总体上有所提高,但一些分支,如AR抑制剂加CDK4/6抑制剂对LAR亚型分支B中的疗效低于预期。文章模式图(图源自Cell Metabolism )铁死亡是一种非凋亡和依赖铁的细胞死亡形式,在代谢功能障碍下游过度脂质过氧化中达到顶峰。铁死亡引起的细胞死亡是通过磷脂过氧化(OxPE,氧化磷脂酰乙醇胺)来完成的,这一过程由脂氧合酶催化,依赖于金属铁、活性氧(ROS)和含有多不饱和脂肪酸链(PE-PUFAs)的磷脂。另一方面,细胞已经进化出至少三种对抗铁死亡的防御机制:谷胱甘肽(GSH)系统、辅酶Q10 (CoQ10)系统和硫氧还蛋白(TXN)系统解毒脂质过氧化氢,抑制铁死亡。诱导铁死亡是一种可探索的治疗策略,因为TNBC是一种富含铁和脂质的肿瘤。重要的是,脂质代谢或氧化还原平衡的干预可导致多发性癌症的铁死亡。然而,最近在乳腺癌背景下对铁死亡的研究主要集中在对调控铁死亡的新分子的探索和新型纳米颗粒的开发。考虑到铁死亡是一个逐步的过程,受多种代谢途径的调控,TNBC中铁死亡的清晰图像仍未揭示。在本研究中,利用一个大型TNBC队列的综合多组学数据来探索TNBC的铁死亡情况。四种TNBC亚型在转录组和代谢组水平上表现出异质性的铁死亡表型。与基因组改变的交叉参照进一步揭示了铁死亡的关键驱动因素。引人注目的是,研究人员提出并实验验证了一种针对LAR肿瘤的GSH过氧化物酶4 (GPX4)抑制剂和免疫检查点封锁的组合治疗。https://www.cell.com/cell-metabolism/fulltext/S1550-4131(22)00411-9