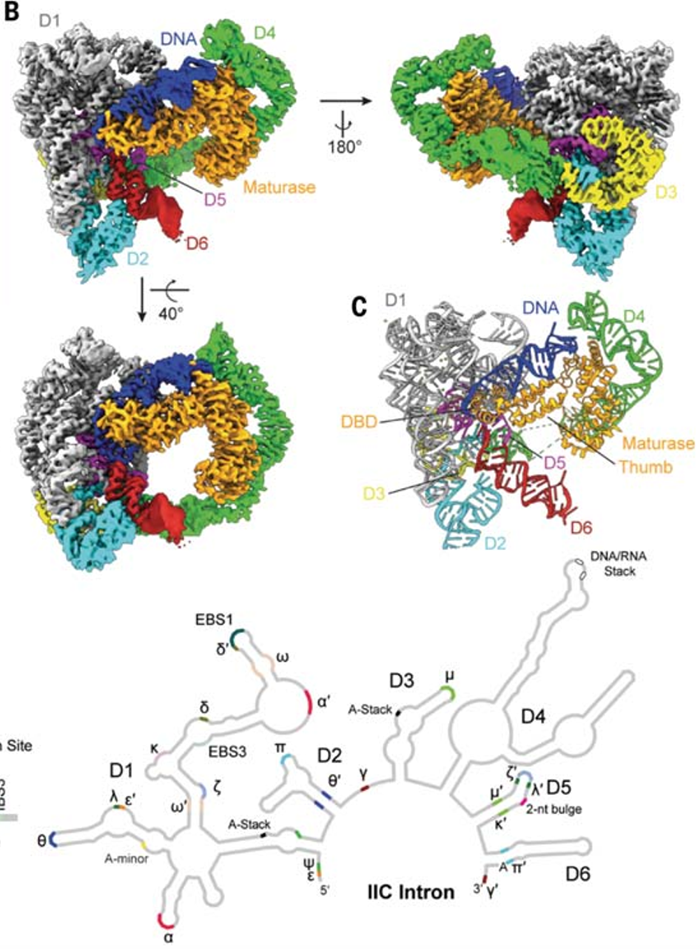
美国耶鲁大学Anna Marie Pyle研究组在Science发文题为Structures of a mobile intron retroelement poised to attack its structured DNA target,解析了一个完整的内含子逆转录元件的低温电子显微镜结构,并且是该转录元件准备攻击整合到DNA茎环基序中的高分辨率结构,揭示出典型逆转录元件成熟酶在RNP组装、DNA识别或化学催化过程中的具体机制作用。II型内含子主要分为三类IIA、IIB和IIC,它们在核酶活性位点周围共享保守的二级结构以及类似的三级结构。其中IIC类内含子是一种古老的细菌内含子,可以识别DNA插入位点的序列和三级结构。与较大的IIA和IIB对应的内含子不同,IIC组内含子几乎完全依赖于它们的成熟酶活性,通过套索形成来促进内含子的切除,从而形成功能性RNP复合体,是逆转录转位的最小元素【4】。因此,作者们将目光集中在IIC逆转录转位结构解析上。为了解决这些问题,作者们解析IIC内含子逆转录元件的低温电子显微镜结构。为了研究DNA插入的机制,作者们在第一步反向剪接到DNA之前捕获了一个II型内含子逆转录元件。首先作者进行了IIC直肠真杆菌(Eubacterium rectale,E.r.)与其编码的成熟酶MarathonRT复合体的体外剪接反应,并对反应混合物进行了纯化。作者们通过生物物理方法对该复合物的纯度和稳定性进行评估。随后作者们使用硫代生物素标记的DNA底物引入内含子成熟酶RNP,并在亲和素柱上通过亲和纯化分离出三元配合物,由此确定其结构(图2)。整体的结构揭示出内含子RNA和成熟酶蛋白的紧密组合,它们通过广泛的相互作用网络与DNA底物密切联系,成熟酶所结合的DNA包含一个短间隔、内含子插入位点和一个IIC内含子独有的5’茎环基序。在该工作中作者们捕获了完整的核酶核心结构,比如对DNA进行亲核攻击的结构、催化三联体结构等为反剪接做好准备。另外也发现了结构中镁离子的定位,这与先前发现的双金属离子催化机制一致。成熟酶蛋白在催化过程中,结构的变化促进多个活性位点的正确形成。这些结构特征揭示出内含子和蛋白质在剪接和逆转录转位过程中存在着不可分割的功能协调关系。进一步地,作者们对全酶识别DNA目标分子的策略进行分析,发现底物DNA通过形状选择性和碱基特异性相互作用的组合被识别。成熟酶与DNA的相互作用使全酶能够协调和选择性地识别DNA螺旋的形状。DNA茎环的这种形状选择性识别策略可以对全酶和DNA靶单链区域之间的序列特异性相互作用进行补充。为了更好地理解内含子逆转录酶结合到DNA底物时可能发生的分子重排,作者们以3.6 Å的分辨率解析了游离内含子-成熟酶复合体的结构,发现DNA底物的结合只会导致非常微小的结构变化。在此情况下,靶标DNA的结合界面是一直维持的,使得RNP能够很容易地识别并且促使DNA靶标进入快速进行逆转录转位。总的来说,作者们工作通过解析逆转录转位的核酶与DNA底物结合的复合体结构,发现IIC内含子成熟酶逆转录元件预形成整合结构,可以随时识别进入的DNA底物茎环结构,为攻击做好准备,由此揭示出一个典型的逆转录元件的工作原理。
原文链接:
http://doi.org/10.1126/science.abq2844